Флуоресценция — Википедия


Флуоресце́нция, или флюоресценция — физический процесс, разновидность люминесценции. Флуоресценцией обычно называют излучательный переход возбужденного состояния с самого нижнего синглетного колебательного уровня S1 в основное состояние S0[источник не указан 141 день]. В общем случае флуоресценцией называют разрешенный по спину излучательный переход между двумя состояниями одинаковой мультиплетности: между синглетными уровнями S1→S0{\displaystyle S_{1}\rightarrow S_{0}} или триплетными T1→T0{\displaystyle T_{1}\rightarrow T_{0}}. Типичное время жизни такого возбужденного состояния составляет 10−11−10−6 с.
Флуоресценцию следует отличать от фосфоресценции — запрещенного по спину излучательного перехода между двумя состояниями разной мультиплетности. Например, излучательный переход возбужденного триплетного состояния T
Происхождение термина
Термин «флуоресценция» происходит от названия минерала флюорит, у которого она впервые была обнаружена, и лат. -escent — суффикс, означающий слабое действие.
История изучения
Впервые флуоресценцию соединений хинина наблюдал физик Джордж Стокс в 1852 году.
Теоретические основы

Согласно представлениям квантовой химии, электроны в атомах расположены на энергетических уровнях. Расстояние между энергетическими уровнями в молекуле зависит от её строения. При облучении вещества светом возможен переход электронов между различными энергетическими уровнями. Разница энергии между энергетическими уровнями и частота колебаний поглощенного света соотносятся между собой уравнением (II постулат Бора):
- E2−E1=hν.{\displaystyle E_{2}-E_{1}=h\nu .}
После поглощения света часть полученной системой энергии расходуется в результате релаксации. Часть же может быть испущена в виде фотона определённой энергии.
Соотношение спектров поглощения и флуоресценции
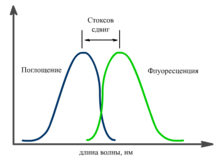
Спектр флуоресценции сдвинут относительно спектра поглощения в сторону длинных волн. Это явление получило название «Стоксов сдвиг». Его причиной являются безызлучательные релаксационные процессы. В результате часть энергии поглощенного фотона теряется, а испускаемый фотон имеет меньшую энергию, и, соответственно, большую длину волны.[1]
Схематическое изображение процессов испускания и поглощения света. Диаграмма Яблонского
Схематически процессы поглощения света и флуоресценции показывают на диаграмме Яблонского.
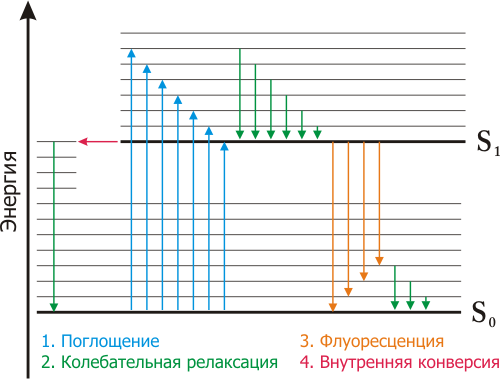
При нормальных условиях большинство молекул находятся в основном электронном состоянии S0{\displaystyle S_{0}}. При поглощении света молекула переходит в возбужденное состояние S1{\displaystyle S_{1}}. При возбуждении на высшие электронные и колебательные уровни избыток энергии быстро расходуется, переводя флуорофор на самый нижний колебательный подуровень состояния S1{\displaystyle S_{1}}. Однако, существуют и исключения: например, флуоресценция азулена может происходить как из S1{\displaystyle S_{1}}, так и из S2{\displaystyle S_{2}} состояния.
Квантовый выход флуоресценции
Квантовый выход флуоресценции показывает, с какой эффективностью проходит данный процесс. Он определяется как отношение количества испускаемых и поглощаемых фотонов. Квантовый выход флуоресценции может быть рассчитан по формуле
- Φ=NemNabs{\displaystyle \Phi ={\frac {N_{em}}{N_{abs}}}}
где Nem{\displaystyle {N_{em}}} — количество испускаемых в результате флуоресценции фотонов, а Nabs{\displaystyle {N_{abs}}} — общее количество поглощаемых фотонов. Чем больше квантовый выход флуорофора, тем интенсивнее его флуоресценция. Квантовый выход можно также определить с помощью упрощенной диаграммы Яблонского[2], где Γ{\displaystyle {\Gamma }} и knr{\displaystyle k_{nr}} — константы скорости излучательной и безызлучательной дезактивации возбужденного состояния.
Тогда доля флуорофоров, возвращающихся в основное состояние с испусканием фотона, и, следовательно, квантовый выход:
- Φ=ΓΓ+knr{\displaystyle \Phi ={\frac {\Gamma }{\Gamma +k_{nr}}}}
Из последней формулы следует, что Φ→1{\displaystyle \Phi \rightarrow 1} если knrΓ→0{\displaystyle {\frac {k_{nr}}{\Gamma }}\rightarrow 0}, то есть если скорость безызлучательного перехода значительно меньше скорости излучательного перехода. Отметим, что квантовый выход всегда меньше единицы из-за стоксовых потерь.
Флуоресцентные соединения
Флюоресценция в ультрафиолетовом свете 0,0001 % водных растворов: голубым — хинина, зелёным — флуоресцеина, оранжевым — родамина-B, жёлтым — родамина-6GК флуоресценции способны многие органические вещества, как правило содержащие систему сопряженных π-связей. Наиболее известными являются хинин, метиловый зелёный, метиловый синий, феноловый красный, кристаллический фиолетовый, бриллиантовый синий кризоловый, POPOP, флуоресцеин, эозин, акридиновые красители (акридиновый оранжевый, акридиновый жёлтый), родамины (родамин 6G, родамин B) и многие другие.
Применение
В производстве красок и окраске текстиля
Флуоресцентные пигменты добавляются в краски, фломастеры, а также при окраске текстильных изделий, предметов обихода, украшений и т. п. для получения особо ярких («кричащих», «кислотных») цветов с повышенным спектральным альбедо в нужном диапазоне длин волн, иногда превышающим 100 %. Данный эффект достигается за счет того, что флуоресцентные пигменты преобразуют содержащийся в естественном свете и в свете многих искусственных источников ультрафиолет (а также для жёлтых и красных пигментов, коротковолновую часть видимого спектра) в излучение нужного диапазона, делая цвет более интенсивным. Особой разновидностью флуоресцентных текстильных пигментов является оптическая синька, преобразующая ультрафиолет в излучение синего цвета, компенсирующее естественный желтоватый оттенок ткани, чем достигается эффект белоснежного цвета одежды и постельного белья. Оптическая синька применяется как при фабричной окраске тканей, так и для освежения цвета при стирке, в стиральных порошках. Аналогичные пигменты применяются и в производстве многих сортов бумаги, включая бумагу для повседневного офисного использования. В ней содержание пигмента с синькой, как правило, наибольшее.
Флуоресцентные краски, в сочетании с «чёрным светом», часто используются в дизайне дискотек и ночных клубов. Практикуется также применение флуоресцентных пигментов в красках для татуировки.
В технике
В технические жидкости, например — антифризы, часто добавляют флюоресцентные добавки, облегчающие поиск течи из агрегата. В ультрафиолетовом свете подтёки такой жидкости становятся очень хорошо заметны.
В биологии и медицине
 Флюоресценция (снизу) под ультрафиолетовым освещением спиртового раствора хлорофилла
Флюоресценция (снизу) под ультрафиолетовым освещением спиртового раствора хлорофилла
В биохимии и молекулярной биологии нашли применение флуоресцентные зонды и красители, которые используются для визуализации отдельных компонентов биологических систем. Например, эозинофилы (клетки крови) называются так потому, что имеют сродство к эозину, благодаря чему легко поддаются подсчёту при анализе крови.
Лазеры
Флуорофоры с высокими квантовыми выходами и хорошей фотостойкостью могут применяться в качестве компонентов активных сред лазеров на красителях.
В криминалистике
Отдельные флуоресцирующие вещества используются в оперативно-розыскной деятельности (для нанесения пометок на деньги, иные предметы в ходе документирования фактов дачи взяток и вымогательства. Также могут использоваться в химловушках)
В гидрологии и экологии
Флуоресцеин был применен в 1877 для доказательства того, что реки Дунай и Рейн соединены подземными каналами.[3]. Краситель внесли в воды Дуная, и спустя несколько часов характерную зелёную флуоресценцию обнаружили в небольшой речке, впадающей в Рейн. Сегодня флуоресцеин используют также как специфический маркер, который облегчает поиск потерпевших крушение летчиков в океане. Для этого просто разбивается ампула с красителем, который, растворяясь в воде, образует хорошо заметное зелёное пятно большого размера. Также флуорофоры могут использоваться для анализа загрязнения окружающей среды (обнаружение утечки нефти (масляных пленок) в морях и океанах).
См. также
Примечания
Литература
- Лабас Ю. А., Гордеева А. В., Фрадков А. Ф. Флуоресцирующие и цветные белки // Природа, 2003, № 3.
- Векшин Н. Л. Флуоресцентная спектроскопия биополимеров. Пущино, Фотон-век, 2009.
- Флюоресценция // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Флуоресценция — статья из Большой советской энциклопедии.
- Лозовская Е. Почему они светятся // Наука и жизнь, 2004, № 8.
- Свечение минералов // Наука и жизнь, 1998, № 5
Ссылки
Флуоресценция — Википедия. Что такое Флуоресценция


Флуоресце́нция, или флюоресценция — физический процесс, разновидность люминесценции. Флуоресценцией обычно называют излучательный переход возбужденного состояния с самого нижнего синглетного колебательного уровня S 1 в основное состояние S0[источник не указан 141 день]. В общем случае флуоресценцией называют разрешенный по спину излучательный переход между двумя состояниями одинаковой мультиплетности: между синглетными уровнями S1→S0{\displaystyle S_{1}\rightarrow S_{0}} или триплетными T1→T0{\displaystyle T_{1}\rightarrow T_{0}}. Типичное время жизни такого возбужденного состояния составляет 10−11−10−6 с.
Флуоресценцию следует отличать от фосфоресценции — запрещенного по спину излучательного перехода между двумя состояниями разной мультиплетности. Например, излучательный переход возбужденного триплетного состояния T1 в основное состояние S0. Синглет-триплетные переходы имеют квантовомеханический запрет, поэтому время жизни возбужденного состояния при фосфоресценции составляет порядка 10
Происхождение термина
Термин «флуоресценция» происходит от названия минерала флюорит, у которого она впервые была обнаружена, и лат. -escent — суффикс, означающий слабое действие.
История изучения
Впервые флуоресценцию соединений хинина наблюдал физик Джордж Стокс в 1852 году.
Теоретические основы

Согласно представлениям квантовой химии, электроны в атомах расположены на энергетических уровнях. Расстояние между энергетическими уровнями в молекуле зависит от её строения. При облучении вещества светом возможен переход электронов между различными энергетическими уровнями. Разница энергии между энергетическими уровнями и частота колебаний поглощенного света соотносятся между собой уравнением (II постулат Бора):
- E2−E1=hν.{\displaystyle E_{2}-E_{1}=h\nu .}
После поглощения света часть полученной системой энергии расходуется в результате релаксации. Часть же может быть испущена в виде фотона определённой энергии.
Соотношение спектров поглощения и флуоресценции
Спектр флуоресценции сдвинут относительно спектра поглощения в сторону длинных волн. Это явление получило название «Стоксов сдвиг». Его причиной являются безызлучательные релаксационные процессы. В результате часть энергии поглощенного фотона теряется, а испускаемый фотон имеет меньшую энергию, и, соответственно, большую длину волны.[1]
Схематическое изображение процессов испускания и поглощения света. Диаграмма Яблонского
Схематически процессы поглощения света и флуоресценции показывают на диаграмме Яблонского.

При нормальных условиях большинство молекул находятся в основном электронном состоянии S0{\displaystyle S_{0}}. При поглощении света молекула переходит в возбужденное состояние S1{\displaystyle S_{1}}. При возбуждении на высшие электронные и колебательные уровни избыток энергии быстро расходуется, переводя флуорофор на самый нижний колебательный подуровень состояния S1{\displaystyle S_{1}}. Однако, существуют и исключения: например, флуоресценция азулена может происходить как из S1{\displaystyle S_{1}}, так и из S2{\displaystyle S_{2}} состояния.
Квантовый выход флуоресценции
Квантовый выход флуоресценции показывает, с какой эффективностью проходит данный процесс. Он определяется как отношение количества испускаемых и поглощаемых фотонов. Квантовый выход флуоресценции может быть рассчитан по формуле
- Φ=NemNabs{\displaystyle \Phi ={\frac {N_{em}}{N_{abs}}}}
где Nem{\displaystyle {N_{em}}} — количество испускаемых в результате флуоресценции фотонов, а Nabs{\displaystyle {N_{abs}}} — общее количество поглощаемых фотонов. Чем больше квантовый выход флуорофора, тем интенсивнее его флуоресценция. Квантовый выход можно также определить с помощью упрощенной диаграммы Яблонского[2], где Γ{\displaystyle {\Gamma }} и knr{\displaystyle k_{nr}} — константы скорости излучательной и безызлучательной дезактивации возбужденного состояния.
Тогда доля флуорофоров, возвращающихся в основное состояние с испусканием фотона, и, следовательно, квантовый выход:
- Φ=ΓΓ+knr{\displaystyle \Phi ={\frac {\Gamma }{\Gamma +k_{nr}}}}
Из последней формулы следует, что Φ→1{\displaystyle \Phi \rightarrow 1} если knrΓ→0{\displaystyle {\frac {k_{nr}}{\Gamma }}\rightarrow 0}, то есть если скорость безызлучательного перехода значительно меньше скорости излучательного перехода. Отметим, что квантовый выход всегда меньше единицы из-за стоксовых потерь.
Флуоресцентные соединения
Флюоресценция в ультрафиолетовом свете 0,0001 % водных растворов: голубым — хинина, зелёным — флуоресцеина, оранжевым — родамина-B, жёлтым — родамина-6GК флуоресценции способны многие органические вещества, как правило содержащие систему сопряженных π-связей. Наиболее известными являются хинин, метиловый зелёный, метиловый синий, феноловый красный, кристаллический фиолетовый, бриллиантовый синий кризоловый, POPOP, флуоресцеин, эозин, акридиновые красители (акридиновый оранжевый, акридиновый жёлтый), родамины (родамин 6G, родамин B) и многие другие.
Применение
В производстве красок и окраске текстиля
Флуоресцентные пигменты добавляются в краски, фломастеры, а также при окраске текстильных изделий, предметов обихода, украшений и т. п. для получения особо ярких («кричащих», «кислотных») цветов с повышенным спектральным альбедо в нужном диапазоне длин волн, иногда превышающим 100 %. Данный эффект достигается за счет того, что флуоресцентные пигменты преобразуют содержащийся в естественном свете и в свете многих искусственных источников ультрафиолет (а также для жёлтых и красных пигментов, коротковолновую часть видимого спектра) в излучение нужного диапазона, делая цвет более интенсивным. Особой разновидностью флуоресцентных текстильных пигментов является оптическая синька, преобразующая ультрафиолет в излучение синего цвета, компенсирующее естественный желтоватый оттенок ткани, чем достигается эффект белоснежного цвета одежды и постельного белья. Оптическая синька применяется как при фабричной окраске тканей, так и для освежения цвета при стирке, в стиральных порошках. Аналогичные пигменты применяются и в производстве многих сортов бумаги, включая бумагу для повседневного офисного использования. В ней содержание пигмента с синькой, как правило, наибольшее.
Флуоресцентные краски, в сочетании с «чёрным светом», часто используются в дизайне дискотек и ночных клубов. Практикуется также применение флуоресцентных пигментов в красках для татуировки.
В технике
В технические жидкости, например — антифризы, часто добавляют флюоресцентные добавки, облегчающие поиск течи из агрегата. В ультрафиолетовом свете подтёки такой жидкости становятся очень хорошо заметны.
В биологии и медицине
 Флюоресценция (снизу) под ультрафиолетовым освещением спиртового раствора хлорофилла
Флюоресценция (снизу) под ультрафиолетовым освещением спиртового раствора хлорофилла
В биохимии и молекулярной биологии нашли применение флуоресцентные зонды и красители, которые используются для визуализации отдельных компонентов биологических систем. Например, эозинофилы (клетки крови) называются так потому, что имеют сродство к эозину, благодаря чему легко поддаются подсчёту при анализе крови.
Лазеры
Флуорофоры с высокими квантовыми выходами и хорошей фотостойкостью могут применяться в качестве компонентов активных сред лазеров на красителях.
В криминалистике
Отдельные флуоресцирующие вещества используются в оперативно-розыскной деятельности (для нанесения пометок на деньги, иные предметы в ходе документирования фактов дачи взяток и вымогательства. Также могут использоваться в химловушках)
В гидрологии и экологии
Флуоресцеин был применен в 1877 для доказательства того, что реки Дунай и Рейн соединены подземными каналами.[3]. Краситель внесли в воды Дуная, и спустя несколько часов характерную зелёную флуоресценцию обнаружили в небольшой речке, впадающей в Рейн. Сегодня флуоресцеин используют также как специфический маркер, который облегчает поиск потерпевших крушение летчиков в океане. Для этого просто разбивается ампула с красителем, который, растворяясь в воде, образует хорошо заметное зелёное пятно большого размера. Также флуорофоры могут использоваться для анализа загрязнения окружающей среды (обнаружение утечки нефти (масляных пленок) в морях и океанах).
См. также
Примечания
Литература
- Лабас Ю. А., Гордеева А. В., Фрадков А. Ф. Флуоресцирующие и цветные белки // Природа, 2003, № 3.
- Векшин Н. Л. Флуоресцентная спектроскопия биополимеров. Пущино, Фотон-век, 2009.
- Флюоресценция // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Флуоресценция — статья из Большой советской энциклопедии.
- Лозовская Е. Почему они светятся // Наука и жизнь, 2004, № 8.
- Свечение минералов // Наука и жизнь, 1998, № 5
Ссылки
Флуоресценция — это… Что такое Флуоресценция?


Флуоресце́нция (вариант: флюоресценция) — физический процесс, разновидность люминесценции. Флуоресценцией обычно называют излучательный переход возбужденного состояния с самого нижнего синглетного колебательного уровня S1 в основное состояние S0. В общем случае флуоресценцией называют разрешенный по спину излучательный переход между двумя состояниями одинаковой мультиплетности: между синглетными уровнями или триплетными . Типичное время жизни такого возбужденного состояния составляет 10−11−10−6 с.
Флуоресценцию следует отличать от фосфоресценции — запрещенного по спину излучательного перехода между двумя состояниями разной мультиплетности. Например, излучательный переход возбужденного триплетного состояния T1 в основное состояние S0. Синглет-триплетные переходы имеют квантово-механический запрет, поэтому время жизни возбужденного состояния при фосфоресценции составляет порядка 10−3−10−2 с.
Происхождение термина
Термин «флуоресценция» происходит от названия минерала флюорит, у которого она впервые была обнаружена, и лат. -escent — суффикс, означающий слабое действие.
История изучения
Впервые флуоресценцию соединений хинина наблюдал физик Джордж Стокс в 1852 году.
Теоретические основы
Согласно представлениям квантовой химии, электроны в атомах расположены на энергетических уровнях. Расстояние между энергетическими уровнями в молекуле зависит от её строения. При облучении вещества светом возможен переход электронов между различными энергетическими уровнями. Разница энергии между энергетическими уровнями и частота колебаний поглощенного света соотносятся между собой уравнением:
После поглощения света часть полученной системой энергии расходуется в результате релаксации. Часть же может быть испущена в виде фотона определённой энергии.
Соотношение спектров поглощения и флуоресценции
Спектр флуоресценции сдвинут относительно спектра поглощения в сторону длинных волн. Это явление получило название «Стоксов сдвиг». Его причиной являются безызлучательные релаксационные процессы. В результате часть энергии поглощенного фотона теряется, а испускаемый фотон имеет меньшую энергию, и, соответственно, большую длину волны.[1]
Схематическое изображение процессов испускания и поглощения света. Диаграмма Яблонского
Схематически процессы поглощения света и флуоресценции показывают на диаграмме Яблонского.
При нормальных условиях большинство молекул находятся в основном электронном состоянии . При поглощении света молекула переходит в возбужденное состояние . При возбуждении на высшие электронные и колебательные уровни избыток энергии быстро расходуется, переводя флуорофор на самый нижний колебательный подуровень состояния . Однако, существуют и исключения: например, флуоресценция азулена может происходить как из , так и из состояния.
Квантовый выход флуоресценции
Квантовый выход флуоресценции показывает, с какой эффективностью проходит данный процесс. Он определяется как отношение количества испускаемых и поглощаемых фотонов. Квантовый выход флуоресценции может быть рассчитан по формуле
где — количество испускаемых в результате флуоресценции фотонов, а — общее количество поглощаемых фотонов. Чем больше квантовый выход флуорофора, тем интенсивнее его флуоресценция. Квантовый выход можно также определить с помощью упрощенной диаграммы Яблонского[2], где и — константы скорости излучательной и безызлучательной дезактивации возбужденного состояния.
Тогда доля флуорофоров, возвращающихся в основное состояние с испусканием фотона, и, следовательно, квантовый выход:
Из последней формулы следует, что если , то есть если скорость безызлучательного перехода значительно меньше скорости излучательного перехода. Отметим, что квантовый выход всегда меньше единицы из-за стоксовых потерь.
Флуоресцентные соединения
К флуоресценции способны многие органические вещества, как правило содержащие систему сопряженных π-связей. Наиболее известными являются хинин, POPOP, флуоресцеин, эозин, акридиновые красители (акридиновый оранжевый, акридиновый желтый), родамины (родамин 6ж, родамин B) и многие другие.
Применение
В производстве красок и окраске текстиля
Флуоресцентные пигменты добавляются в краски, фломастеры, а также при окраске текстильных изделий, предметов обихода, украшений и т. п. для получения особо ярких («кричащих», «кислотных») цветов с повышенным спектральным альбедо в нужном диапазоне длин волн, иногда превышающим 100%. Данный эффект достигается за счет того, что флуоресцентные пигменты преобразуют содержащийся в естественном свете и в свете многих искусственных источников ультрафиолет (а также, для жёлтых и красных пигментов, коротковолновую часть видимого спектра) в излучение нужного диапазона, делая цвет более интенсивным. Особой разновидностью флуоресцентных текстильных пигментов является оптическая синька, преобразующая ультрафиолет в излучение синего цвета, компенсирующее естественный желтоватый оттенок ткани, чем достигается эффект белоснежного цвета одежды и постельного белья. Оптическая синька применяется как при фабричной окраске тканей, так и, для освежения цвета при стирке, в стиральных порошках. Аналогичные пигменты применяются и в производстве особо высококачественной мелованной бумаги.
Флуоресцентные краски, в сочетании с «чёрным светом», часто используются в дизайне дискотек и ночных клубов. Практикуется также применение флуоресцентных пигментов в красках для татуировки.
В биологии и медицине
В биохимии и молекулярной биологии нашли применение флуоресцентные зонды и красители, которые используются для визуализации отдельных компонентов биологических систем. Например, эозинофилы (клетки крови) называются так потому, что имеют сродство к эозину, благодаря чему легко поддаются подсчёту при анализе крови.
Лазеры
Флуорофоры с высокими квантовыми выходами и хорошей фотостойкостью могут применяться в качестве компонентов активных сред лазеров на красителях.
В криминалистике
Отдельные флуоресцирующие вещества используются в оперативно-розыскной деятельности (для нанесения пометок на деньги, иные предметы в ходе документирования фактов дачи взяток и вымогательства. Также могут использоваться в химловушках)
В гидрологии и экологии
Флуоресцеин был применен в 1877 для доказательства того, что реки Дунай и Рейн соединены подземными каналами. [3]. Краситель внесли в воды Дуная, и спустя несколько часов характерную зелёную флуоресценцию обнаружили в небольшой речке, впадающей в Рейн. Сегодня флуоресцеин используют также как специфический маркер, который облегчает поиск потерпевших крушение летчиков в океане. Для этого просто разбивается ампула с красителем, который, растворяясь в воде, образует хорошо заметное зелёное пятно большого размера. Также флуорофоры могут использоваться для анализа загрязнения окружающей среды (обнаружение утечки нефти (масляных пленок) в морях и океанах).
См. также
Литература
Англоязычная
- Bernard Valeur Molecular Fluorescence: Principles and Applications. — Wiley-VCH Verlag GmbH, 2001. — ISBN 3-527-60024-8
- Joseph R. Lakowicz. Principles of Fluorescence Spectroscopy / R. J. Lakowicz. -N.Y.: Springer Science, 2006. — 960 p.
Примечания
Флуоресценция — Википедия


Флуоресце́нция, или флюоресценция — физический процесс, разновидность люминесценции. Флуоресценцией обычно называют излучательный переход возбужденного состояния с самого нижнего синглетного колебательного уровня S1 в основное состояние S0[источник не указан 141 день]. В общем случае флуоресценцией называют разрешенный по спину излучательный переход между двумя состояниями одинаковой мультиплетности: между синглетными уровнями S1→S0{\displaystyle S_{1}\rightarrow S_{0}} или триплетными T1→T0{\displaystyle T_{1}\rightarrow T_{0}}. Типичное время жизни такого возбужденного состояния составляет 10−11−10−6 с.
Флуоресценцию следует отличать от фосфоресценции — запрещенного по спину излучательного перехода между двумя состояниями разной мультиплетности. Например, излучательный переход возбужденного триплетного состояния T1 в основное состояние S0. Синглет-триплетные переходы имеют квантовомеханический запрет, поэтому время жизни возбужденного состояния при фосфоресценции составляет порядка 10−3−10−2 с.
Происхождение термина
Термин «флуоресценция» происходит от названия минерала флюорит, у которого она впервые была обнаружена, и лат. -escent — суффикс, означающий слабое действие.
История изучения
Впервые флуоресценцию соединений хинина наблюдал физик Джордж Стокс в 1852 году.
Теоретические основы

Согласно представлениям квантовой химии, электроны в атомах расположены на энергетических уровнях. Расстояние между энергетическими уровнями в молекуле зависит от её строения. При облучении вещества светом возможен переход электронов между различными энергетическими уровнями. Разница энергии между энергетическими уровнями и частота колебаний поглощенного света соотносятся между собой уравнением (II постулат Бора):
- E2−E1=hν.{\displaystyle E_{2}-E_{1}=h\nu .}
После поглощения света часть полученной системой энергии расходуется в результате релаксации. Часть же может быть испущена в виде фотона определённой энергии.
Соотношение спектров поглощения и флуоресценции
Спектр флуоресценции сдвинут относительно спектра поглощения в сторону длинных волн. Это явление получило название «Стоксов сдвиг». Его причиной являются безызлучательные релаксационные процессы. В результате часть энергии поглощенного фотона теряется, а испускаемый фотон имеет меньшую энергию, и, соответственно, большую длину волны.[1]
Схематическое изображение процессов испускания и поглощения света. Диаграмма Яблонского
Схематически процессы поглощения света и флуоресценции показывают на диаграмме Яблонского.

При нормальных условиях большинство молекул находятся в основном электронном состоянии S0{\displaystyle S_{0}}. При поглощении света молекула переходит в возбужденное состояние S1{\displaystyle S_{1}}. При возбуждении на высшие электронные и колебательные уровни избыток энергии быстро расходуется, переводя флуорофор на самый нижний колебательный подуровень состояния S1{\displaystyle S_{1}}. Однако, существуют и исключения: например, флуоресценция азулена может происходить как из S1{\displaystyle S_{1}}, так и из S2{\displaystyle S_{2}} состояния.
Квантовый выход флуоресценции
Квантовый выход флуоресценции показывает, с какой эффективностью проходит данный процесс. Он определяется как отношение количества испускаемых и поглощаемых фотонов. Квантовый выход флуоресценции может быть рассчитан по формуле
- Φ=NemNabs{\displaystyle \Phi ={\frac {N_{em}}{N_{abs}}}}
где Nem{\displaystyle {N_{em}}} — количество испускаемых в результате флуоресценции фотонов, а Nabs{\displaystyle {N_{abs}}} — общее количество поглощаемых фотонов. Чем больше квантовый выход флуорофора, тем интенсивнее его флуоресценция. Квантовый выход можно также определить с помощью упрощенной диаграммы Яблонского[2], где Γ{\displaystyle {\Gamma }} и knr{\displaystyle k_{nr}} — константы скорости излучательной и безызлучательной дезактивации возбужденного состояния.
Тогда доля флуорофоров, возвращающихся в основное состояние с испусканием фотона, и, следовательно, квантовый выход:
- Φ=ΓΓ+knr{\displaystyle \Phi ={\frac {\Gamma }{\Gamma +k_{nr}}}}
Из последней формулы следует, что Φ→1{\displaystyle \Phi \rightarrow 1} если knrΓ→0{\displaystyle {\frac {k_{nr}}{\Gamma }}\rightarrow 0}, то есть если скорость безызлучательного перехода значительно меньше скорости излучательного перехода. Отметим, что квантовый выход всегда меньше единицы из-за стоксовых потерь.
Флуоресцентные соединения
Флюоресценция в ультрафиолетовом свете 0,0001 % водных растворов: голубым — хинина, зелёным — флуоресцеина, оранжевым — родамина-B, жёлтым — родамина-6GК флуоресценции способны многие органические вещества, как правило содержащие систему сопряженных π-связей. Наиболее известными являются хинин, метиловый зелёный, метиловый синий, феноловый красный, кристаллический фиолетовый, бриллиантовый синий кризоловый, POPOP, флуоресцеин, эозин, акридиновые красители (акридиновый оранжевый, акридиновый жёлтый), родамины (родамин 6G, родамин B) и многие другие.
Применение
В производстве красок и окраске текстиля
Флуоресцентные пигменты добавляются в краски, фломастеры, а также при окраске текстильных изделий, предметов обихода, украшений и т. п. для получения особо ярких («кричащих», «кислотных») цветов с повышенным спектральным альбедо в нужном диапазоне длин волн, иногда превышающим 100 %. Данный эффект достигается за счет того, что флуоресцентные пигменты преобразуют содержащийся в естественном свете и в свете многих искусственных источников ультрафиолет (а также для жёлтых и красных пигментов, коротковолновую часть видимого спектра) в излучение нужного диапазона, делая цвет более интенсивным. Особой разновидностью флуоресцентных текстильных пигментов является оптическая синька, преобразующая ультрафиолет в излучение синего цвета, компенсирующее естественный желтоватый оттенок ткани, чем достигается эффект белоснежного цвета одежды и постельного белья. Оптическая синька применяется как при фабричной окраске тканей, так и для освежения цвета при стирке, в стиральных порошках. Аналогичные пигменты применяются и в производстве многих сортов бумаги, включая бумагу для повседневного офисного использования. В ней содержание пигмента с синькой, как правило, наибольшее.
Флуоресцентные краски, в сочетании с «чёрным светом», часто используются в дизайне дискотек и ночных клубов. Практикуется также применение флуоресцентных пигментов в красках для татуировки.
В технике
В технические жидкости, например — антифризы, часто добавляют флюоресцентные добавки, облегчающие поиск течи из агрегата. В ультрафиолетовом свете подтёки такой жидкости становятся очень хорошо заметны.
В биологии и медицине
 Флюоресценция (снизу) под ультрафиолетовым освещением спиртового раствора хлорофилла
Флюоресценция (снизу) под ультрафиолетовым освещением спиртового раствора хлорофилла
В биохимии и молекулярной биологии нашли применение флуоресцентные зонды и красители, которые используются для визуализации отдельных компонентов биологических систем. Например, эозинофилы (клетки крови) называются так потому, что имеют сродство к эозину, благодаря чему легко поддаются подсчёту при анализе крови.
Лазеры
Флуорофоры с высокими квантовыми выходами и хорошей фотостойкостью могут применяться в качестве компонентов активных сред лазеров на красителях.
В криминалистике
Отдельные флуоресцирующие вещества используются в оперативно-розыскной деятельности (для нанесения пометок на деньги, иные предметы в ходе документирования фактов дачи взяток и вымогательства. Также могут использоваться в химловушках)
В гидрологии и экологии
Флуоресцеин был применен в 1877 для доказательства того, что реки Дунай и Рейн соединены подземными каналами.[3]. Краситель внесли в воды Дуная, и спустя несколько часов характерную зелёную флуоресценцию обнаружили в небольшой речке, впадающей в Рейн. Сегодня флуоресцеин используют также как специфический маркер, который облегчает поиск потерпевших крушение летчиков в океане. Для этого просто разбивается ампула с красителем, который, растворяясь в воде, образует хорошо заметное зелёное пятно большого размера. Также флуорофоры могут использоваться для анализа загрязнения окружающей среды (обнаружение утечки нефти (масляных пленок) в морях и океанах).
См. также
Примечания
Литература
- Лабас Ю. А., Гордеева А. В., Фрадков А. Ф. Флуоресцирующие и цветные белки // Природа, 2003, № 3.
- Векшин Н. Л. Флуоресцентная спектроскопия биополимеров. Пущино, Фотон-век, 2009.
- Флюоресценция // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Флуоресценция — статья из Большой советской энциклопедии.
- Лозовская Е. Почему они светятся // Наука и жизнь, 2004, № 8.
- Свечение минералов // Наука и жизнь, 1998, № 5
Ссылки
Флуоресценция — Википедия. Что такое Флуоресценция


Флуоресце́нция, или флюоресценция — физический процесс, разновидность люминесценции. Флуоресценцией обычно называют излучательный переход возбужденного состояния с самого нижнего синглетного колебательного уровня S1 в основное состояние S0[источник не указан 133 дня]. В общем случае флуоресценцией называют разрешенный по спину излучательный переход между двумя состояниями одинаковой мультиплетности: между синглетными уровнями S1→S0{\displaystyle S_{1}\rightarrow S_{0}} или триплетными T1→T0{\displaystyle T_{1}\rightarrow T_{0}}. Типичное время жизни такого возбужденного состояния составляет 10−11−10−6 с.
Флуоресценцию следует отличать от фосфоресценции — запрещенного по спину излучательного перехода между двумя состояниями разной мультиплетности. Например, излучательный переход возбужденного триплетного состояния T1 в основное состояние S0. Синглет-триплетные переходы имеют квантовомеханический запрет, поэтому время жизни возбужденного состояния при фосфоресценции составляет порядка 10−3−10−2 с.
Происхождение термина
Термин «флуоресценция» происходит от названия минерала флюорит, у которого она впервые была обнаружена, и лат. -escent — суффикс, означающий слабое действие.
История изучения
Впервые флуоресценцию соединений хинина наблюдал физик Джордж Стокс в 1852 году.
Теоретические основы

Согласно представлениям квантовой химии, электроны в атомах расположены на энергетических уровнях. Расстояние между энергетическими уровнями в молекуле зависит от её строения. При облучении вещества светом возможен переход электронов между различными энергетическими уровнями. Разница энергии между энергетическими уровнями и частота колебаний поглощенного света соотносятся между собой уравнением (II постулат Бора):
- E2−E1=hν.{\displaystyle E_{2}-E_{1}=h\nu .}
После поглощения света часть полученной системой энергии расходуется в результате релаксации. Часть же может быть испущена в виде фотона определённой энергии.
Соотношение спектров поглощения и флуоресценции
Спектр флуоресценции сдвинут относительно спектра поглощения в сторону длинных волн. Это явление получило название «Стоксов сдвиг». Его причиной являются безызлучательные релаксационные процессы. В результате часть энергии поглощенного фотона теряется, а испускаемый фотон имеет меньшую энергию, и, соответственно, большую длину волны.[1]
Схематическое изображение процессов испускания и поглощения света. Диаграмма Яблонского
Схематически процессы поглощения света и флуоресценции показывают на диаграмме Яблонского.

При нормальных условиях большинство молекул находятся в основном электронном состоянии S0{\displaystyle S_{0}}. При поглощении света молекула переходит в возбужденное состояние S1{\displaystyle S_{1}}. При возбуждении на высшие электронные и колебательные уровни избыток энергии быстро расходуется, переводя флуорофор на самый нижний колебательный подуровень состояния S1{\displaystyle S_{1}}. Однако, существуют и исключения: например, флуоресценция азулена может происходить как из S1{\displaystyle S_{1}}, так и из S2{\displaystyle S_{2}} состояния.
Квантовый выход флуоресценции
Квантовый выход флуоресценции показывает, с какой эффективностью проходит данный процесс. Он определяется как отношение количества испускаемых и поглощаемых фотонов. Квантовый выход флуоресценции может быть рассчитан по формуле
- Φ=NemNabs{\displaystyle \Phi ={\frac {N_{em}}{N_{abs}}}}
где Nem{\displaystyle {N_{em}}} — количество испускаемых в результате флуоресценции фотонов, а Nabs{\displaystyle {N_{abs}}} — общее количество поглощаемых фотонов. Чем больше квантовый выход флуорофора, тем интенсивнее его флуоресценция. Квантовый выход можно также определить с помощью упрощенной диаграммы Яблонского[2], где Γ{\displaystyle {\Gamma }} и knr{\displaystyle k_{nr}} — константы скорости излучательной и безызлучательной дезактивации возбужденного состояния.
Тогда доля флуорофоров, возвращающихся в основное состояние с испусканием фотона, и, следовательно, квантовый выход:
- Φ=ΓΓ+knr{\displaystyle \Phi ={\frac {\Gamma }{\Gamma +k_{nr}}}}
Из последней формулы следует, что Φ→1{\displaystyle \Phi \rightarrow 1} если knrΓ→0{\displaystyle {\frac {k_{nr}}{\Gamma }}\rightarrow 0}, то есть если скорость безызлучательного перехода значительно меньше скорости излучательного перехода. Отметим, что квантовый выход всегда меньше единицы из-за стоксовых потерь.
Флуоресцентные соединения
Флюоресценция в ультрафиолетовом свете 0,0001 % водных растворов: голубым — хинина, зелёным — флуоресцеина, оранжевым — родамина-B, жёлтым — родамина-6GК флуоресценции способны многие органические вещества, как правило содержащие систему сопряженных π-связей. Наиболее известными являются хинин, метиловый зелёный, метиловый синий, феноловый красный, кристаллический фиолетовый, бриллиантовый синий кризоловый, POPOP, флуоресцеин, эозин, акридиновые красители (акридиновый оранжевый, акридиновый жёлтый), родамины (родамин 6G, родамин B) и многие другие.
Применение
В производстве красок и окраске текстиля
Флуоресцентные пигменты добавляются в краски, фломастеры, а также при окраске текстильных изделий, предметов обихода, украшений и т. п. для получения особо ярких («кричащих», «кислотных») цветов с повышенным спектральным альбедо в нужном диапазоне длин волн, иногда превышающим 100 %. Данный эффект достигается за счет того, что флуоресцентные пигменты преобразуют содержащийся в естественном свете и в свете многих искусственных источников ультрафиолет (а также для жёлтых и красных пигментов, коротковолновую часть видимого спектра) в излучение нужного диапазона, делая цвет более интенсивным. Особой разновидностью флуоресцентных текстильных пигментов является оптическая синька, преобразующая ультрафиолет в излучение синего цвета, компенсирующее естественный желтоватый оттенок ткани, чем достигается эффект белоснежного цвета одежды и постельного белья. Оптическая синька применяется как при фабричной окраске тканей, так и для освежения цвета при стирке, в стиральных порошках. Аналогичные пигменты применяются и в производстве многих сортов бумаги, включая бумагу для повседневного офисного использования. В ней содержание пигмента с синькой, как правило, наибольшее.
Флуоресцентные краски, в сочетании с «чёрным светом», часто используются в дизайне дискотек и ночных клубов. Практикуется также применение флуоресцентных пигментов в красках для татуировки.
В технике
В технические жидкости, например — антифризы, часто добавляют флюоресцентные добавки, облегчающие поиск течи из агрегата. В ультрафиолетовом свете подтёки такой жидкости становятся очень хорошо заметны.
В биологии и медицине
 Флюоресценция (снизу) под ультрафиолетовым освещением спиртового раствора хлорофилла
Флюоресценция (снизу) под ультрафиолетовым освещением спиртового раствора хлорофилла
В биохимии и молекулярной биологии нашли применение флуоресцентные зонды и красители, которые используются для визуализации отдельных компонентов биологических систем. Например, эозинофилы (клетки крови) называются так потому, что имеют сродство к эозину, благодаря чему легко поддаются подсчёту при анализе крови.
Лазеры
Флуорофоры с высокими квантовыми выходами и хорошей фотостойкостью могут применяться в качестве компонентов активных сред лазеров на красителях.
В криминалистике
Отдельные флуоресцирующие вещества используются в оперативно-розыскной деятельности (для нанесения пометок на деньги, иные предметы в ходе документирования фактов дачи взяток и вымогательства. Также могут использоваться в химловушках)
В гидрологии и экологии
Флуоресцеин был применен в 1877 для доказательства того, что реки Дунай и Рейн соединены подземными каналами.[3]. Краситель внесли в воды Дуная, и спустя несколько часов характерную зелёную флуоресценцию обнаружили в небольшой речке, впадающей в Рейн. Сегодня флуоресцеин используют также как специфический маркер, который облегчает поиск потерпевших крушение летчиков в океане. Для этого просто разбивается ампула с красителем, который, растворяясь в воде, образует хорошо заметное зелёное пятно большого размера. Также флуорофоры могут использоваться для анализа загрязнения окружающей среды (обнаружение утечки нефти (масляных пленок) в морях и океанах).
См. также
Примечания
Литература
- Лабас Ю. А., Гордеева А. В., Фрадков А. Ф. Флуоресцирующие и цветные белки // Природа, 2003, № 3.
- Векшин Н. Л. Флуоресцентная спектроскопия биополимеров. Пущино, Фотон-век, 2009.
- Флюоресценция // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Флуоресценция — статья из Большой советской энциклопедии.
- Лозовская Е. Почему они светятся // Наука и жизнь, 2004, № 8.
- Свечение минералов // Наука и жизнь, 1998, № 5
Ссылки
Флуоресценция Википедия
Флуоресце́нция, или флюоресценция — физический процесс, разновидность люминесценции. Флуоресценцией обычно называют излучательный переход возбуждённого состояния с самого нижнего синглетного колебательного уровня S1 в основное состояние S0[источник не указан 829 дней]. В общем случае флуоресценцией называют разрешённый по спину излучательный переход между двумя состояниями одинаковой мультиплетности: между синглетными уровнями S1→S0{\displaystyle S_{1}\rightarrow S_{0}} или триплетными T1→T0{\displaystyle T_{1}\rightarrow T_{0}}. Типичное время жизни такого возбуждённого состояния составляет 10−11−10−6 с[1].
Флуоресценцию следует отличать от фосфоресценции — запрещённого по спину излучательного перехода между двумя состояниями разной мультиплетности. Например, излучательный переход возбуждённого триплетного состояния T1 в основное состояние S0. Синглет-триплетные переходы имеют квантовомеханический запрет, поэтому время жизни возбуждённого состояния при фосфоресценции составляет порядка 10−3−10−2 с[2].
Происхождение термина
Термин «флуоресценция» происходит от названия минерала флюорит, у которого она впервые была обнаружена, и лат. -escent — суффикс, означающий слабое действие.
История изучения
Впервые флуоресценцию соединений хинина наблюдал физик Джордж Стокс в 1852 году.
Теоретические основы
Согласно представлениям квантовой химии, электроны в атомах расположены на энергетических уровнях. Расстояние между энергетическими уровнями в молекуле зависит от её строения. При облучении вещества светом возможен переход электронов между различными энергетическими уровнями. Разница энергии между энергетическими уровнями и частота колебаний поглощённого света соотносятся между собой уравнением (II постулат Бора):
- E2−E1=hν.{\displaystyle E_{2}-E_{1}=h\nu .}
После поглощения света часть полученной системой энергии расходуется в результате релаксации. Часть же может быть испущена в виде фотона определённой энергии[3].
Соотношение спектров поглощения и флуоресценции
Спектр флуоресценции сдвинут относительно спектра поглощения в сторону длинных волн. Это явление получило название «Стоксов сдвиг». Его причиной являются безызлучательные релаксационные процессы. В результате часть энергии поглощённого фотона теряется, а испускаемый фотон имеет меньшую энергию, и, соответственно, большую длину волны[4][5].
Схематическое изображение процессов испускания и поглощения света. Диаграмма Яблонского
Схематически процессы поглощения света и флуоресценции показывают на диаграмме Яблонского.
При нормальных условиях большинство молекул находятся в основном электронном состоянии S0{\displaystyle S_{0}}. При поглощении света молекула переходит в возбуждённое состояние S1{\displaystyle S_{1}}. При возбуждении на высшие электронные и колебательные уровни избыток энергии быстро расходуется, переводя флуорофор на самый нижний колебательный подуровень состояния S1{\displaystyle S_{1}}. Однако, существуют и исключения: например, флуоресценция азулена может происходить как из S1{\displaystyle S_{1}}, так и из S2{\displaystyle S_{2}} состояния.
Квантовый выход флуоресценции
Квантовый выход флуоресценции показывает, с какой эффективностью проходит данный процесс. Он определяется как отношение количества испускаемых и поглощаемых фотонов. Квантовый выход флуоресценции может быть рассчитан по формуле
- Φ=NemNabs{\displaystyle \Phi ={\frac {N_{em}}{N_{abs}}}}
где Nem{\displaystyle {N_{em}}} — количество испускаемых в результате флуоресценции фотонов, а Nabs{\displaystyle {N_{abs}}} — общее количество поглощаемых фотонов. Чем больше квантовый выход флуорофора, тем интенсивнее его флуоресценция. Квантовый выход можно также определить с помощью упрощённой диаграммы Яблонского[6], где Γ{\displaystyle {\Gamma }} и knr{\displaystyle k_{nr}} — константы скорости излучательной и безызлучательной дезактивации возбуждённого состояния.
Тогда доля флуорофоров, возвращающихся в основное состояние с испусканием фотона, и, следовательно, квантовый выход:
- Φ=ΓΓ+knr{\displaystyle \Phi ={\frac {\Gamma }{\Gamma +k_{nr}}}}
Из последней формулы следует, что Φ→1{\displaystyle \Phi \rightarrow 1} если knrΓ→0{\displaystyle {\frac {k_{nr}}{\Gamma }}\rightarrow 0}, то есть если скорость безызлучательного перехода значительно меньше скорости излучательного перехода. Отметим, что квантовый выход всегда меньше единицы из-за стоксовых потерь.
Флуоресцентные соединения
Флюоресценция в ультрафиолетовом свете 0,0001 % водных растворов: голубым — хинина, зелёным — флуоресцеина, оранжевым — родамина-B, жёлтым — родамина-6GК флуоресценции способны многие органические вещества, как правило содержащие систему сопряжённых π-связей. Наиболее известными являются хинин, метиловый зелёный, метиловый синий, феноловый красный, кристаллический фиолетовый, бриллиантовый синий кризоловый, POPOP, флуоресцеин, эозин, акридиновые красители (акридиновый оранжевый, акридиновый жёлтый), родамины (родамин 6G, родамин B), нильский красный и многие другие.
Применение
В производстве красок и окраске текстиля
Флуоресцентные пигменты добавляются в краски, фломастеры, а также при окраске текстильных изделий, предметов обихода, украшений и т. п. для получения особо ярких («кричащих», «кислотных») цветов с повышенным спектральным альбедо в нужном диапазоне длин волн, иногда превышающим 100 %. Данный эффект достигается за счёт того, что флуоресцентные пигменты преобразуют содержащийся в естественном свете и в свете многих искусственных источников ультрафиолет (а также для жёлтых и красных пигментов, коротковолновую часть видимого спектра) в излучение нужного диапазона, делая цвет более интенсивным. Особой разновидностью флуоресцентных текстильных пигментов является оптическая синька, преобразующая ультрафиолет в излучение синего цвета, компенсирующее естественный желтоватый оттенок ткани, чем достигается эффект белоснежного цвета одежды и постельного белья. Оптическая синька применяется как при фабричной окраске тканей, так и для освежения цвета при стирке, в стиральных порошках. Аналогичные пигменты применяются и в производстве многих сортов бумаги, включая бумагу для повседневного офисного использования. В ней содержание пигмента с синькой, как правило, наибольшее.
Флуоресцентные краски, в сочетании с «чёрным светом», часто используются в дизайне дискотек и ночных клубов. Практикуется также применение флуоресцентных пигментов в красках для татуировки.
В технике
В технические жидкости, например — антифризы, часто добавляют флюоресцентные добавки, облегчающие поиск течи из агрегата. В ультрафиолетовом свете подтёки такой жидкости становятся очень хорошо заметны.
В биологии и медицине
Флюоресценция (снизу) под ультрафиолетовым освещением спиртового раствора хлорофиллаВ биохимии и молекулярной биологии нашли применение флуоресцентные зонды и красители, которые используются для визуализации отдельных компонентов биологических систем. Например, эозинофилы (клетки крови) называются так потому, что имеют сродство к эозину, благодаря чему легко поддаются подсчёту при анализе крови.
Лазеры
Флуорофоры с высокими квантовыми выходами и хорошей фотостойкостью могут применяться в качестве компонентов активных сред лазеров на красителях.
В криминалистике
Отдельные флуоресцирующие вещества используются в оперативно-разыскной деятельности (для нанесения пометок на деньги, иные предметы в ходе документирования фактов дачи взяток и вымогательства. Также могут использоваться в химловушках)
В гидрологии и экологии
Флуоресцеин был применен в 1877 для доказательства того, что реки Дунай и Рейн соединены подземными каналами.[7]. Краситель внесли в воды Дуная и спустя несколько часов характерную зелёную флуоресценцию обнаружили в небольшой речке, впадающей в Рейн. Сегодня флуоресцеин используют также как специфический маркёр, который облегчает поиск потерпевших крушение лётчиков в океане. Для этого просто разбивается ампула с красителем, который, растворяясь в воде, образует хорошо заметное зелёное пятно большого размера. Также флуорофоры могут использоваться для анализа загрязнения окружающей среды (обнаружение утечки нефти (масляных плёнок) в морях и океанах).
См. также
Примечания
Литература
- Лабас Ю. А., Гордеева А. В., Фрадков А. Ф. Флуоресцирующие и цветные белки // Природа, 2003, № 3.
- Векшин Н. Л. Флуоресцентная спектроскопия биополимеров. Пущино, Фотон-век, 2009.
- Флюоресценция // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Флуоресценция — статья из Большой советской энциклопедии.
- Лозовская Е. Почему они светятся // Наука и жизнь, 2004, № 8.
- Свечение минералов // Наука и жизнь, 1998, № 5
Ссылки
Флуоресцентные репортеры и их репортажи
Е. О. Пучков,
доктор биологических наук, Институт биохимии и физиологии микроорганизмов им. Г. К. Скрябина РАН
«Химия и жизнь» №9, 2014
Как известно, однажды свет был успешно отделен от тьмы. С тем, что такое тьма, еще предстоит разобраться: пока наметились лишь некоторые перспективы в связи с изучением темной материи и темной энергии. А вот свет человечество давно изучает и использует, в том числе и как исследовательский инструмент.
В последние тридцать лет стремительно растет число методов исследования, основанных на регистрации флуоресценции, и они все шире применяются в биологии и медицине. Обусловлено это как развитием техники, в первую очередь компьютеров и лазеров, так и появлением широкого спектра доступных флуоресцирующих молекул и молекулярных комплексов, так называемых флуоресцентных репортеров. Флуоресцентная методология благодаря высокой чувствительности и сравнительной безопасности вытеснила многие традиционные методы, связанные с применением радиоактивных веществ. Методы флуоресцентного анализа используются как в фундаментальных исследованиях для получения новых знаний о живом, так и в прикладных работах — в биотехнологии, медицинской диагностике, криминалистике… Что же представляют собой флуоресцентные репортеры? Какую информацию из глубин микромира можно получить с их помощью? Как эту информацию регистрируют и анализируют? Но прежде всего — что такое флуоресценция?
Флуоресценция: свечение, индуцированное светом
Некоторые вещества после поглощения света в определенном диапазоне длин волн начинают излучать свет в другом, более длинноволновом диапазоне. Давно было замечено, что растворы некоторых органических соединений и минералов изменяют цвет, если наблюдать их не на просвет, а под углом к проходящему свету. Так, например, шотландский натуралист Дэвид Брюстер в 1833 году заметил, что от зеленого спиртового раствора хлорофилла при освещении белым светом «отражается» красный свет. Позднее, в 1845 году, знаменитый астроном и физик Джон Гершель описал появление голубой окраски у бесцветного раствора сульфата хинина при облучении солнечным светом. В 1852 году математик и физик Джордж Стокс обнаружил видимое глазом свечение минерала флуорита при его облучении невидимым ультрафиолетовым излучением. «В честь» флуорита он назвал это явление флуоресценцией, по аналогии с термином «опалесценция», описывающим явление дихроизма в опале. (Опалесценция — это разновидность дихроизма: рассеяние света, которое иногда сопровождается интерференцией. Хотя опалы тоже выглядят желтоватыми в проходящем свете и голубоватыми — в рассеянном, перпендикулярном к проходящему, это не флуоресценция.)
Флуоресценция — один из видов люминесценции. Этим термином описывают все виды излучения, вызванного возбуждением молекул различными факторами. Так, например, в некоторых химических реакциях возникает хемилюминесценция. Хемилюминесценцию в биологических объектах называют биолюминесценцией. Есть вещества, которые испускают свет при возбуждении электрическим током (электролюминесценция), быстрыми электронами (катодолюминесценция), Y-излучением (радиолюминесценция) и другие. В этом контексте флуоресценция относится к категории фотолюминесценции.
Способные флуоресцировать атомы, молекулы и молекулярные комплексы называют флуорофорами, или флуорохромами. Иногда флуорохромами называют все виды флуоресцирующих молекул, а флуорофорами — только флуоресцирующие компоненты (группировки) крупной молекулы. Однако дальше мы будем использовать термин «флуорофор» для всех типов флуоресцирующих веществ. Отметим также, что в исследовательской практике ковалентно присоединенный к макромолекуле флуоресцирующий компонент принято называть флуоресцентной меткой, а свободный флуорофор — зондом. Применяемые в микроскопии флуорофоры традиционно именуют флуоресцентными красителями. Наконец, флуорофоры, используемые в биологических исследованиях, некоторые авторы стали называть биосенсорами. Физическую природу флуоресценции удобно проиллюстрировать, пользуясь диаграммой, которую предложил польский физик Александр Яблонский в 1933 году и которая носит его имя (рис. 1).
Отметим три важных обстоятельства. Во-первых, вероятности переходов, показанных на рис. 1, различаются. О вероятности можно судить по времени, за которое осуществляется каждый из переходов, или по времени пребывания электронов в каждом из этих состояний (см. таблицу): чем меньше время, тем более вероятен данный переход. Очевидно, что флуоресценция и тем более фосфоресценция — маловероятные процессы. Вот почему большинство флуорофоров светятся слабо даже при интенсивном облучении. Во-вторых, поскольку флуоресценция возможна при переходе электронов в основное состояние только с самого низкого синглетного уровня, энергия излучения меньше поглощенной энергии. Поэтому спектр флуоресценции флуорофора всегда находится в более длинноволновой области по сравнению со спектром поглощения. И наконец, в-третьих, состояние электронов, участвующих в процессах, зависит как от физических факторов окружающей среды, так и от общей электронной конфигурации молекулы. Именно это обстоятельство и делает флуорохром молекулярным репортером, который на языке флуоресценции сообщает о физико-химических условиях своего окружения. Молекулярный репортер, в отличие от газетного репортёра, произносится с ударением на второй слог. Но задачи перед ними стоят сходные: проникнуть туда, куда поручили, и отправить репортаж с места событий.
Времена потенциальных переходов электронов между разными энергетическими состояниями в флуорофорах
| Переход | Временной интервал | Участие светового излучения |
| Поглощение | 10–15 с | + |
| Внутренняя конверсия | 10–14–10–11 с | – |
| Вибрационная релаксация | 10–14–10–11 с | – |
| Флуоресценция | 10–9–10–7 с | + |
| Интеркомбинационная конверсия | 10–8–10–3 с | – |
| Фосфоресценция | 10–4–10–1 с | + |
Язык флуоресцентных репортеров
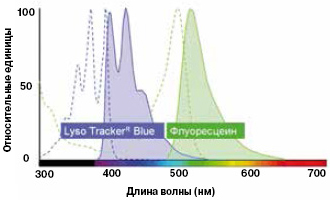

Итак, параметры флуоресценции — язык, с помощью которого флуоресцентный репортер передает информацию. Если продолжить аналогию, то параметры подобно словам приобретают смысл только в контексте, иначе говоря, с учетом условий регистрации. У каждого флуорофора имеется пять ключевых характеристик: спектры поглощения и флуоресценции, а также квантовый выход, время жизни и анизотропия флуоресценции.
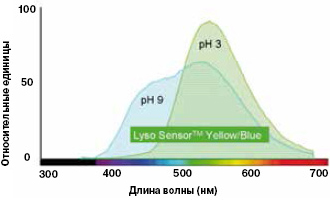
Спектры поглощения и флуоресценции показывают, свет с какими длинами волн преимущественно поглощает и излучает данное вещество (рис. 2). Основные параметры спектра — интенсивность флуоресценции, положение максимума и так называемая полуширина (ширина спектра на уровне половины максимума). Можно считать, что максимум спектра флуоресценции — это ее цвет, например, если максимум около 540 нм, это означает, что свечение в данных условиях будет зеленым. Оговорка про условия не случайна. Часто именно эти параметры информируют наблюдателя о свойствах окружения, в котором находится репортер. Так, в спектре флуоресценции многих флуорохромов возникают характерные изменения при сдвиге рН среды. Если такие изменения могут быть вызваны только изменениями кислотности и ничем иным, то флуорофор может быть своего рода молекулярным рН-метром — рН-репортером. Характерный пример — Lyso SensorTM Yellow/Blue, чьи спектры показаны на рис. 3.

Квантовый выход флуоресценции — это характеристика эффективности, с которой поглощенная энергия трансформируется в излучение по сравнению с процессами безызлучательной релаксации. Количественно он определяется как отношение числа высвеченных фотонов к числу поглощенных. Чем больше квантовый выход, тем больше интенсивность свечения флуорофора. Флуоресцентный репортер часто выбирают именно по этому показателю. Например, флуоресцеин с квантовым выходом около 0,9 (почти единица!) широко применяют как в роли самостоятельного зонда, так и в качестве флуоресцентной метки нефлуоресцирующих молекул. Важно также и то, что этот показатель очень чувствителен к физико-химическим взаимодействиям репортера.
Время жизни флуоресценции — усредненное время, в течение которого молекулы флуорофоров находятся в возбужденном состоянии перед испусканием фотонов. Измеряют этот показатель по затуханию флуоресценции после кратковременного возбуждения. Время жизни флуоресценции, с одной стороны, очень чувствительно к физико-химической «обстановке», в которой находится репортер. С другой стороны, у каждого флуорофора это время свое, что позволяет получать репортажи из одного образца от флуоресцирующих молекул с похожими спектральными характеристиками. Приходя в разное время, сигналы не перекрываются.
Наконец, анизотропия флуоресценции — количественная характеристика зависимости поляризации флуоресценции от поляризации возбуждающего света. По анизотропии можно судить о вращательной подвижности репортера и тем самым о вязкости среды в его микроокружении.
Но информационные возможности флуоресцентных репортеров этим не ограничиваются. Так, например, существует явление безызлучательной, или резонансной, передачи энергии (БПЭ) от одного флуорофора на другой. При этом интенсивность флуоресценции у донора энергии уменьшается, а у акцептора возрастает. Передача возможна между флуорофорами с определенными спектральными свойствами — и, что особенно важно, находящимися на достаточно близком расстоянии. Это позволяет выявлять взаимодействие молекул и даже оценивать расстояние между ними. Вот почему БПЭ иногда называют «молекулярной линейкой».
Интересные возможности исследователям предоставляет тушение флуоресценции при физическом взаимодействии флуорофора с молекулами-тушителями, такими, как кислород, галогены, амины, некоторые электрондефицитные органические молекулы. В этом случае флуоресцентный репортер сообщает о присутствии в его окружении определенных тушителей.
Тушение флуорофора может происходить также за счет фотообесцвечивания под влиянием излучения большой интенсивности. Обычно это явление мешает экспериментатору, но в умелых руках может стать специальным методическим приемом. Так, наблюдение за восстановлением флуоресценции флуорофора после фотообесцвечивания дает информацию о вязкости и диффузионных свойств цитоплазмы. В небольшом участке клетки, содержащей флуорофор, его обесцвечивают кратковременной мощной вспышкой лазера, а затем наблюдают, как флуоресценция восстанавливается за счет диффузии необесцвеченных молекул из других участков клетки.
Какие они, флуоресцентные репортеры?
Условно можно выделить две группы репортеров, созданных на основе органических и неорганических флуорофоров.
Органические флуорофоры наиболее многочисленны и разнообразны. Как велико это разнообразие, можно представить, заглянув в каталог фирмы «Molecular Probes», специализирующейся на разработке и производстве флуорофоров c 1975 года. На момент написания статьи по ссылке было уже одиннадцатое обновление каталога: темпы роста в этой области впечатляют.
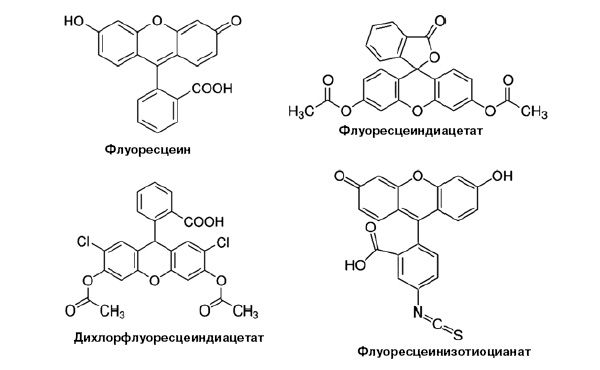
У каждого репортера — своя специализация: достоинства и возможности каждого определяют круг задач, для решения которых его применяют. Проиллюстрируем это на примере флуоресцеина и его производных (рис. 4). Как уже отмечалось, этот флуорофор имеет высокий квантовый выход и соответственно яркую флуоресценцию. Он может быть репортером рН, однако для измерения рН внутри клеток он не подходит, так как не проникает через цитоплазматическую мембрану. Зато мембрану может преодолеть его гидрофобное производное — флуоресцеиндиацетат. Правда, ацетильные группы лишают его возможности флуоресцировать, но внутри клетки их отщепляют ферменты эстеразы. Аналогичным образом (в форме диацетата) доставляется в клетки дихлорфлуоресцеин, который служит для регистрации в клетках активных форм кислорода. Если присоединить к молекуле флуоресцеина изотиоцианатную группу, такой флуорохром будет связываться с аминогруппами нефлуоресцирующих молекул. Таким образом делают флуоресцирующие антитела, стрептавидин (реагент на биотин), а также нуклеотиды и олигонуклеотиды. Наконец, 5-карбоксиметокси-2-нитробензиловый эфир флуоресцеина (не показан на рис. 4) сам не флуоресцирует, но превращается в обычный флуоресцеин при облучении светом с длиной волны 355 нм.
В 70-х годах ХХ века при изучении биолюминесценции медузы Aequorea victoria были выделены два белка, участвующих в этом процессе. Они всем известны с тех пор, как Нобелевскую премию по химии 2008 года получили их открыватели и создатели исследовательских инструментов на их основе — Осаму Шимомура, Мартин Челфи и Роджер Тсиен (см. «Химию и жизнь», 2008, №12), Один из этих белков, экворин, в присутствии ионов кальция окисляет свою простетическую группу, причем возникает хемилюминесценция голубого цвета; второй белок поглощает голубой свет и флуоресцирует зеленым.
Этому второму белку, названному просто green fluorescent protein (зеленый флуоресцентный белок — GFP, или ЗФБ), суждена была громкая слава. После открытия GFP начались интенсивные исследования его структуры, был клонирован его ген. Оказалось, что этот ген сравнительно несложно экспрессировать в клетках других организмов. Можно также соединить его с геном другого белка и внедрить этот гибридный ген в клетку — тогда она начнет синтезировать белок с флуоресцентной меткой. Позднее у некоторых морских беспозвоночных (кораллов и полипов) обнаружили аналогичные белки с другими спектрами флуоресценции. Методы молекулярной биологии позволили сконструировать гены, кодирующие модифицированные формы флуоресцентных белков с широким диапазоном спектральных характеристик, а также фоторегулируемые варианты, свечение которых можно включать и выключать с помощью ультрафиолетового излучения. Сегодня к услугам исследователей на основе GFP созданы флуоресцентные белки всех цветов радуги, с самыми разнообразными свойствами, и постоянно появляются новые.
Несколько скромнее пока выглядит судьба экворина. Изучение зависимости его хемилюминесценции от ионов кальция позволило разработать методики измерения концентрации Ca2+ в некоторых клетках. Для этого существуют и флуоресцентные репортеры, однако хемилюминесцентный метод с использованием экворина не требует облучения, возбуждающего флуоресценцию, которое не всегда безвредно для биологической системы. Экворин относят к сравнительно большой группе люциферинов — веществ, ответственных за био(хеми)люминесценцию у некоторых морских и наземных организмов. Они интересны не только с точки зрения их практического применения: ведь до сих пор идут споры о том, зачем биологическим объектам вообще нужна биолюминесценция.
Неорганические флуорофоры чаще всего используют в составе так называемых биоконъюгатов — комплексов с органическими соединениями или биомолекулами. Многие атомы, например, переходные металлы, лантаниды (точнее, их ионы, например Tb3+ и Eu3), кластеры из нескольких атомов золота и серебра, в составе таких комплексов приобретают способность к сенсибилизированной флуоресценции. Энергия света, поглощенного органическим соединением, передается на атом неорганического элемента, который и излучает флуоресценцию. Важно то, что молекулы — доноры энергии передают ее от электронов, находящихся в триплетном состоянии. Поэтому излучение неорганических флуорофоров в таком комплексе замедленно по сравнению с обычной флуоресценцией, поскольку время жизни электронов в триплетном состоянии заметно больше, чем в синглетном (см. таблицу 1). Кроме того, спектры флуоресценции неорганических биоконъюгатов имеют небольшую ширину и сильно сдвинуты относительно спектров поглощения. Благодаря этому неорганические био-конъюгаты можно использовать и тогда, когда в исследуемой системе присутствуют другие компоненты, флуоресцирующие в том же диапазоне длин волн.
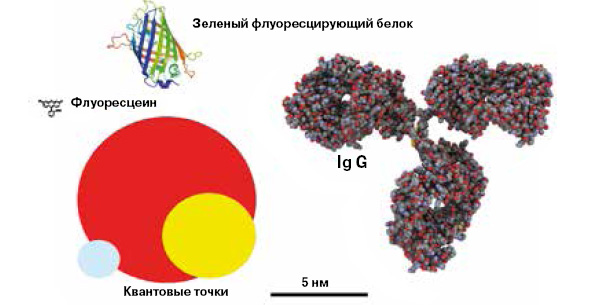
Особое место в этой группе занимают репортеры-биоконъюгаты, в которых в качестве флуорофора используются полупроводниковые кристаллы размером 2–10 нм (нанокристаллы), получившие название квантовых точек — quantum dots. Как правило, они состоят из пары элементов III/V (например, CdS, CdSe, ZnS) или II/VI групп (например, GaN, InP, InAs). Из-за малых размеров полупроводниковых кристаллов (в них всего по 10–50 атомов!) для электронов создаются условия квантованных энергетических переходов, подобных тем, что существуют в отдельных атомах. (Квантовые точки иногда даже называют «искусственными атомами».) При этом энергия переходов, а тем самым и длина волны флуоресценции зависят от размера кристалла. Чем меньше кристалл, тем больше энергия излучения, то есть меньше длина волны флуоресценции (см. фото на первой врезке). Это свойство открывает возможность создания квантовых точек практически с любой спектральной конфигурацией. Добавим, что по сравнению с органическими флуорофорами они обладают более высоким квантовым выходом и фотостабильностью. На рис. 5 показаны примерные размеры различных флуорофоров-репортеров.
Биоконъюгаты на основе квантовых точек состоят из ядра (например, CdSe), которое покрыто слоем полупроводникового материала (например, ZnS), выполняющим защитную функцию, и лиганда — какого-нибудь органического вещества, обеспечивающего растворимость и/или присоединение биологических молекул. Биоорганическая оболочка обеспечивает стабильность биоконъюгата как коллоидной частицы и формирует задание репортера, его назначение: где и с чем провзаимодействовать, какую собрать и передать информацию. При этом, конечно, размеры репортера на основе квантовой точки могут существенно увеличиться (рис. 5). В биоорганическую оболочку включают и низкомолекулярные соединения, такие, как биотин, и высокомолекулярные — одноцепочечные фрагменты ДНК, белки, в том числе ферменты или антитела (IgG).
Как читают флуоресцентные репортажи…
Первым в списке инструментов для получения и анализа сообщений флуоресцентных репортеров был человеческий глаз. Флуоресцентное свечение макроскопических объектов мы наблюдаем непосредственно, а микроскопических — с помощью флуоресцентного (люминесцентного) микроскопа. Примерами макроскопических объектов могут служить колонии микроорганизмов, в которых экспрессированы флуоресцентные белки, или хроматограммы и электрофореграммы с применением флуоресцентных красителей. В обычный флуоресцентный микроскоп (о необычных микроскопах — см. врез ниже), как правило, заглядывают для выявления иммунологических реакций с использованием меченных флуорофорами антител, применяют их и в некоторых исследованиях на уровне единичных клеток.
Особо отметим эстетическую информативность этих методов. Флуоресцентные репортеры на микрофотографиях открывают нам чарующий мир разнообразных цветов и форм (см. фото на второй странице обложки). Фирмы-производители микроскопов «Nikon» и «Olympus» даже проводят ежегодные конкурсы фоторабот о микромире в свете флуоресценции (работы-победители см. на сайтах The Olympus BioScapes Competition и Nikon’s Small World.
В отличие от флуоресцентных микроскопов, проточные цитометры не дают возможности полюбоваться флуоресцирующими объектами. Их сильная сторона — скорость регистрации сигналов от единичных объектов, например от клеток в суспензии. Обычный коммерчески доступный цитометр работает со скоростью 1000 клеток в секунду, а специализированные высокопроизводительные — до 25 000 клеток в секунду! В стандартном варианте у каждого объекта измеряются от двух до десяти параметров: светорассеяния и флуоресценции одного или нескольких флуорофоров. Таким образом можно получить статистически достоверные результаты по гетерогенности клеточных, в частности микробных, популяций. Существуют также приборы, способные сортировать клетки по определенным параметрам светорассеяния или флуоресценции, чтобы затем изучать субпопуляции с использованием других методов.
…И что из них можно узнать
Итак, все флуоресцентные репортеры имеют специализацию, то есть способны избирательно характеризовать определенные свойства биологической системы. Остановимся вкратце на некоторых категориях «специалистов».
С помощью ряда флуоресцентных репортеров (как правило, органических флуорофоров) можно следить за ферментативным катализом — исследовать динамику ферментативных реакций, их локализацию в клетках, тканях, органах и т. п. Это, например, субстраты с ковалентно присоединенными флуорофорами, которые начинают флуоресцировать только после высвобождения в ходе реакции, или «профлуорофоры», становящиеся флуоресцентными при взаимодействии с продуктом реакции.
Репортеры, сформированные на основе антител — физические комплексы или ковалентные соединения флуорофоров с антителами, — информируют о протекании иммунологических реакций. Флуоресцирующим компонентом может быть любой из известных органических и неорганических флуорофоров, включая квантовые точки. Кроме того, к антителам можно присоединять ферменты, катализирующие реакции с образованием флуоресцирующего продукта. Современные технологии позволяют получить антитела к любому белку (антигену), интересующему исследователя, антитело же с флуоресцентной меткой заставит светиться этот белок или структуру, из него построенную. Например, с помощью флуоресцентных антител выявлены микрофибриллы в фибробластах мышей (см. фото на второй странице обложки).
Очень информативны методы с использованием флуоресцентных белков (ФБ). Мы уже упоминали о том, как полезны методы внедрения в клетку генов гибридных белков, которые заставляют флуоресцировать естественный белок или даже нуклеиновую кислоту. Вдобавок флуоресценция ФБ-содержащих гибридных белков зависит от кислотности среды, что позволяет измерять рН не только внутри клетки, но и внутри отдельных органелл, если такой белок «адресован» в ядро или митохондрию.
Особый интерес вызывает применение ФБ в сочетании с методиками измерения флуоресценции, основанными на безызлучательной передаче энергии. Представьте себе два гибридных белка, один из которых заставляет флуоресцировать другой при сближении. Подобным же образом можно изучать конформационные (структурные) изменения в белках, если присоединить ФБ к разным участкам одной белковой молекулы.
Чувствительность флуоресценции к физическим свойствам микроокружения флуорофоров позволяет использовать некоторых из них в качестве репортеров различных параметров внутриклеточной среды. В их числе, например, вязкость цитоплазмы, внутреннего содержимого органелл, гидрофобного слоя биомембран. Взаимодействие некоторых флуорофоров с биологическими мембранами зависит от разности электрических потенциалов на мембране: с помощью таких репортеров получают сведения о величине мембранного потенциала. Существуют даже репортеры для измерения внутриклеточной температуры!
Что высветили в микромире флуоресцентные репортеры
Флуоресцентные репортеры долго и успешно служат во многих, если не во всех областях экспериментальной биологии. Однако есть такие области, где они сыграли ключевую роль.
С использованием флуоресцентных репортеров была экспериментально доказана модель жидкокристаллической структуры всех биологических мембран. Согласно этой модели, при всей ее структурной целостности мембрана достаточно «жидкая», чтобы отдельные ее компоненты могли перемещаться в нужные стороны. Такое представление позволяет понять основные молекулярные механизмы функционирования мембран, а также свойства живых клеток в целом.
В значительной мере благодаря информации от флуоресцентных репортеров прояснились механизмы трансформации энергии в клетках. Особую роль здесь сыграли флуорофоры, позволяющие регистрировать внутриклеточный и внутримитохондриальный рН, а также разность электрических потенциалов на мембранах. С их помощью прежде всего был выявлен механизм сопряжения энергодонорных реакций окисления с энергозатратным синтезом аденозинтрифосфата (АТФ) — универсального поставщика энергии для большинства метаболических процессов. Кроме того, была изучена природа накопления различных веществ в цитоплазме и в клеточных органеллах за счет мембранного электрического потенциала и градиента рН.
Жизнедеятельность клеток обеспечивается совокупностью скоординированных в пространстве и времени биохимических реакций, а за координацию отвечают так называемые сигнальные системы. Основные компоненты этих систем были изолированы и охарактеризованы с помощью методов традиционной биохимии и молекулярной биологии. Однако только подходы, основанные на применении флуоресцентных репортеров, показали напрямую, где пролегают эти пути и как по ним проходят сигналы, — стало возможным в реальном времени следить за взаимодействиями сигнальных белков или оценивать динамику экспрессии генов в отдельно взятой клетке. С помощью флуоресцентных репортеров удалось обнаружить и неизвестные ранее сигнальные компоненты, например выявить роль ионов Са+2 как сигнального посредника во многих регуляторных реакциях.
Во второй половине ХХ века в микробиологии возникла проблема, которую окрестили «великой аномалией учета микроорганизмов с помощью чашек Петри». «Виновниками» оказались флуоресцентные репортеры, два красителя нуклеиновых кислот — акридиновый оранжевый и 4,6-диамидино-2-фенилиндол. Оценить содержание микроорганизмов в природном образце можно, либо подсчитывая колонии, выросшие на чашке Петри (при достаточном разведении «посевного материала» каждую колонию образуют потомки лишь одной клетки), либо напрямую подсчитывая под микроскопом сами микроорганизмы, прокрашенные флуоресцентными красителями нуклеиновых кислот. Так вот, флуоресцентные репортеры всегда выявляли значительно больше микроорганизмов, чем анализ с чашками Петри.
Для объяснения этого противоречия были выдвинуты две гипотезы. Согласно первой, часть клеток, находящихся в состоянии покоя, не размножается на чашках Петри. Согласно второй, условия культивирования (состав среды, температура и др.) не соответствуют потребностям некоторой части популяции. Проверка этих гипотез показала, что возможно и то, и другое. Более того, был дан толчок к формированию двух новых больших направлений исследований. Первое связано с изучением так называемого жизнеспособного, но некультивируемого состояния микроорганизмов. Понятна практическая значимость таких исследований: например, патогены человека в этом состоянии могут быть невидимы для стандартных методов диагностики и более устойчивы к лекарственным препаратам. Второе направление — выявление и изучение микроорганизмов в природных образцах путем прямого анализа их нуклеиновых кислот, без предварительного получения чистых культур, как это делалось раньше. Это направление получило собственное название — метагеномика. Благодаря методам метагеномики (кстати, некоторые из этих методов предполагают использование флуоресцентных репортеров) появилась возможность по-новому увидеть биологическое разнообразие микроорганизмов в отдельных экосистемах и на Земле в целом.
Итак, современные флуоресцентные репортеры — это огромная армия специалистов, и многие из них уже имеют громкую славу в экспериментальной биологии. Их репортажи позволили лучше разглядеть те уголки микромира, куда может заглянуть свет. Однако многие исследователи, работающие в данной области, считают, что все, увиденное нами в свете флуоресценции до сих пор, — это только начало!
люминесцентные зонды | Thermo Fisher Scientific
Использование флуоресцентных молекул в биологических исследованиях является стандартом во многих приложениях, и их использование постоянно расширяется благодаря их универсальности, чувствительности и количественным возможностям. Среди множества сфер их применения флуоресцентные зонды используются для определения местоположения и активации белков, определения образования белковых комплексов и конформационных изменений, а также для мониторинга биологических процессов in vivo .Для получения этого репрезентативного изображения использовались методы иммунофлуоресценции.

Обнаружение целевых белков с использованием антител, конъюгированных с флуорофором. Синаптофизин (красный) и связанный с микротрубочками белок 2 (MAP2; зеленый) в нейронах коры мозга мышей флуоресцентно метили специфическими первичными антителами и конъюгированными Thermo Scientific DyLight 650 козьими анти-кроличьими антителами или DyLight 488-конъюгированными козьими анти-мышиными вторичными антителами. соответственно.Ядра на обеих панелях были помечены красителем Hoechst.
Введение в флуоресценцию
Механизм флуоресценции
Флуоресцентные молекулы, также называемые флуорофорами или просто флюорами, отчетливо реагируют на свет по сравнению с другими молекулами.Как показано ниже, фотон возбуждающего света поглощается электроном флуоресцентной частицы, что переводит энергетический уровень электрона в возбужденное состояние. В течение этого короткого периода возбуждения часть энергии рассеивается в результате столкновений молекул или передается проксимальной молекуле, а оставшаяся энергия излучается в виде фотона, чтобы вернуть электрон в его основное состояние. Поскольку испускаемый фотон обычно несет меньше энергии и, следовательно, имеет большую длину волны, чем фотон возбуждения, испускаемую флуоресценцию можно отличить от света возбуждения.Возбуждение и испускание фотонов флуорофором цикличны, и до тех пор, пока флуорофор не будет необратимо поврежден (см. «Обесцвечивание фото» ниже), его можно повторно возбуждать. Таким образом, флуорофоры могут испускать множество фотонов в этом цикле возбуждения и испускания, поэтому флуоресцентные молекулы используются для широкого спектра исследовательских приложений.
Посмотрите это видео, чтобы узнать больше об основах флуоресценции.
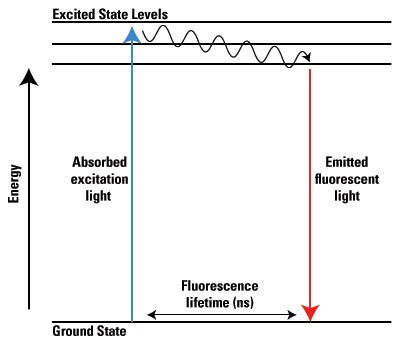
Энергетическая диаграмма флуоресценции Яблонского.
Техническое руководство по анализу белков
Это техническое руководство и руководство по продукту помогут вам выбрать подходящий метод анализа на основе времени анализа, чувствительности, совместимости, линейности стандартной кривой и вариации от белка к белку.Узнайте о нашем широком спектре колориметрических (на основе меди или красителя) и флуоресцентных анализов белков, а также о наших более специализированных анализах для количественного определения пептидов, антител, модификаций белков или функциональных (ферментативных) классов белков. Откройте для себя инструменты и стратегии, которые помогут оптимизировать анализы количественного определения протеина, чтобы обеспечить более точные последующие результаты
Скачать справочник

Спектры флуоресценции
Длины волн возбуждения и излучения являются специфическими характеристиками для каждого флуорофора, и хотя эти длины волн дискретны для одноатомных флуорофоров, многоатомные флуорофоры демонстрируют широкие спектры возбуждения и излучения.Спектры флуоресцентных молекул (как одно-, так и многоатомных) нанесены на графики x, y, которые указывают длины волн, которые соответствуют максимальной и минимальной интенсивности сигнала возбуждения и излучения для каждого флуорофора, как показано ниже (левая панель). Важно отметить, что хотя длина волны излучения не зависит от длины волны возбуждения из-за частичной потери энергии перед излучением (как показано выше), интенсивность излучения пропорциональна амплитуде длины волны возбуждения, на что указывают энергии возбуждения. (Ex1 и Ex2) и соответствующие им интенсивности излучения (Em1 и Em2 соответственно) на графике ниже (правая панель) (2).

Спектры возбуждения и излучения флуорофора и корреляция между амплитудой возбуждения и интенсивностью излучения. Общая схема спектров возбуждения и излучения флуорофора (слева). Интенсивность излучаемого света (Em1 и Em2) прямо пропорциональна энергии, необходимой для возбуждения флуорофора на любой длине волны возбуждения (Ex1 и Ex2 соответственно; справа).
Сдвиг Стокса
Расстояние между длинами волн возбуждения и излучения называется стоксовым сдвигом (см. Ниже) и является ключевым аспектом при обнаружении испускаемой флуоресценции в биологических приложениях. Стоксов сдвиг также является отличительной характеристикой каждого флуорофора. Например, обнаружение испускаемой флуоресценции может быть трудно отличить от света возбуждения при использовании флуорофоров с очень малыми стоксовыми сдвигами (правая панель), потому что длины волн возбуждения и испускания сильно перекрываются.И наоборот, флуорофоры с большим стоксовым сдвигом (левая панель) легко различить из-за большого разделения между длинами волн возбуждения и излучения. Стоксов сдвиг особенно важен в приложениях мультиплексной флуоресценции, потому что длина волны излучения одного флуора может перекрываться и, следовательно, возбуждать другой флуор в том же образце.

Стоксов сдвиг спектров возбуждения и излучения флуорофора. Флуорофоры с большими стоксовыми сдвигами (слева) демонстрируют четкое различие между возбуждающим и испускаемым светом в образце, тогда как флуорофоры с меньшими стоксовыми сдвигами (справа) демонстрируют больший фоновый сигнал из-за меньшей разницы между длинами волн возбуждения и излучения.
Цветовая гамма
Электромагнитный спектр — это широкий диапазон всех длин волн электромагнитного излучения, а спектр видимого света ограничен очень небольшим подмножеством этих длин волн, как показано ниже.В ранних приложениях, основанных на флуоресценции, использовались флуорофоры, которые излучали только в видимом диапазоне электромагнитного спектра (390–700 нм) из-за ограничений при обнаружении за пределами видимого спектра. Технологические достижения позволяют обнаруживать флуорофоры за пределами видимого спектра, а также в ультрафиолетовом (УФ) и инфракрасном (ИК) диапазонах электромагнитного спектра. Эти новые флуорофоры и детекторы предлагают большую вариативность, универсальность и возможности мультиплексирования для новых и развивающихся приложений.

Спектр видимого света с указанием приблизительной длины волны.
Яркость флуорофора
Яркость данного флуорофора определяется коэффициентом молярной экстинкции и квантовым выходом, которые являются специфическими для каждого фтора.Молярный коэффициент экстинкции (ε) определяется как количество света, которое может быть поглощено флюором на данной длине волны, и измеряется в M -1 см -1 . Квантовый выход (Φ) рассчитывается как количество фотонов, испускаемых флюором, деленное на количество фотонов, которые поглощаются. Этот расчет обеспечивает эффективность флуорофора и имеет максимум 1. Яркость флуорофора затем вычисляется как произведение ε и Φ.
Виды флуорофоров
Флуоресценция использовалась в биологических исследованиях в течение последних 100 лет, хотя разработки в химии флуоресценции, наряду с техническими открытиями, способствовали развитию многих различных видов флуорофоров.Огромный выбор флуорофоров сегодня обеспечивает большую гибкость, вариативность и эффективность флуорофоров для исследовательских приложений, чем когда-либо прежде. Флуорофоры можно разделить на три основные группы:
- Органические красители
- Биологические флуорофоры
- Квантовые точки
Каждый флуорофор имеет различные характеристики, которые следует учитывать при принятии решения, какой флуорофор использовать для данного приложения или экспериментальной системы.
Красители органические
Синтетические органические красители, такие как флуоресцеин, были первыми флуоресцентными соединениями, использованными в биологических исследованиях.Производные этих исходных соединений были произведены для улучшения их фотостабильности и растворимости. Эти красители также дериватизируются для использования в биоконъюгации, особенно флуоресцеинизотиоцианат (FITC), родамин (тетраметилродамина изотиоцианат, TRITC) и коммерческие варианты с более высокими характеристиками. Небольшой размер этих флуорофоров является преимуществом по сравнению с биологическими флуорофорами для стратегий биоконъюгации, поскольку они могут быть сшиты с макромолекулами, такими как антитела, биотин или авидин, без нарушения надлежащей биологической функции.Широкий спектр красителей с характеристическими спектрами возбуждения / испускания и оптимальными квантовыми выходами и коэффициентами возбуждения коммерчески доступен для любого применения флуоресценции.
Биологические флуорофоры
Хотя биолюминесценция известна на протяжении тысячелетий, первое использование биологического флуорофора для исследовательских целей произошло в 1990-х годах, когда зеленый флуоресцентный белок (GFP) был клонирован из медузы Aequorea victoria и использован в качестве репортера экспрессии генов (3) .С того времени производные исходного GFP, фикобилипротеины (аллофикоцианин), фикоцианин, фикоэритрин и фикоэритроцианин) и многих других белков были разработаны для использования в биологических системах экспрессии, и их использование в настоящее время является обычным явлением в биологических исследованиях.
Преимущество этих типов флуорофоров заключается в том, что плазмиды экспрессии могут быть введены в бактерии, клетки, органы или целые организмы, чтобы управлять экспрессией этого флуорофора либо отдельно, либо слитым с интересующим белком в контексте изучаемых биологических процессов.Использование флуоресцентных белков может занять много времени, а экспрессия больших количеств светопродуцирующих белков может генерировать активные формы кислорода и вызывать артефактические реакции или токсичность. Кроме того, размер флуоресцентного белка может изменить нормальную биологическую функцию клеточного белка, с которым слит флуорофор, а биологические флуорофоры обычно не обеспечивают уровень фотостабильности и чувствительности, предлагаемый синтетическими флуоресцентными красителями.
Квантовые точки
Квантовые точки — это нанокристаллы с уникальными химическими свойствами, которые обеспечивают жесткий контроль над спектральными характеристиками фтора.Квантовые точки были разработаны в 1980-х годах, а с 1990-х годов все чаще используются в приложениях флуоресценции в биологических исследованиях. Квантовые точки — это полупроводники наноразмеров (2-50 нм), которые при возбуждении излучают флуоресценцию на длине волны, зависящей от размера частицы; Квантовые точки меньшего размера излучают более высокую энергию, чем большие квантовые точки, и поэтому излучаемый свет смещается с синего на красный по мере увеличения размера нанокристалла. А поскольку размер квантовых точек можно жестко контролировать, существует большая специфичность для различных длин волн возбуждения и излучения, чем у других флуоресцентных ламп.

Многоцветная иммунофлуоресцентная визуализация с конъюгатами вторичных антител Qdot. Ламинин в срезе почки мыши был помечен первичным антителом против ламинина и визуализирован с использованием флуоресцентного зеленого Qdot 565 IgG. PECAM (молекула адгезии тромбоцитов / эндотелиальных клеток; CD31) метили первичным антителом против PECAM-1 и визуализировали с помощью флуоресцентного Qdot 655 IgG с красным светом. Ядра окрашивали флуоресцентным голубым светом Hoechst 33342
.Также сообщалось, что
квантовые точки более фотостабильны, чем другие флуорофоры, поскольку в одном отчете показано, что квантовые точки оставались флуоресцентными в течение 4 месяцев в исследовании визуализации in vivo (1).Кроме того, на квантовые точки может быть нанесено покрытие для использования в различных биологических приложениях, таких как маркировка белков. В то время как использование квантовых точек в биологических приложениях растет, есть сообщения о токсичности клеток в ответ на разрушение частиц (4), и их использование может быть дорогостоящим.
Техническое руководство по обнаружению белков
Это 84-страничное руководство содержит подробное описание последнего шага в рабочем процессе вестерн-блоттинга — обнаружения белков.Имея на выбор множество методов обнаружения (хемилюминесцентный, флуоресцентный или хромогенный), вы можете выбрать технологию, соответствующую вашим экспериментальным требованиям и имеющимся у вас инструментам. Быстрая визуализация или точный количественный анализ, детекция с помощью одного зонда или мультиплексирование — доступен ряд реагентов и наборов для вестерн-блоттинга и последующего анализа.
Запросить загрузку ›

Обнаружение и количественный анализ флуоресценции
Стратегии обнаружения
Было разработано много различных типов приборов для обнаружения флуоресценции, и, хотя каждый из них является специфическим для различных экспериментальных методов, все приборы для обнаружения флуоресценции имеют четыре основных требования:
- Источник возбуждающего света, такой как лазеры, фотодиоды или лампы (ксеноновая дуга и пары ртути являются наиболее часто используемыми лампами)
- Флуорофор
- Фильтры для выделения определенных длин волн для возбуждения различных флуорофоров
- Детектор, регистрирующий выходной сигнал, обычно электронный сигнал
Хотя этот список не является исчерпывающим и новые приборы постоянно разрабатываются, обычные приборы для обнаружения флуоресценции включают:
- Флуоресцентные микроскопы — обнаруживают локализованные флюоры в образцах как в двух, так и в трех измерениях
- Сканеры флуоресценции, такие как считыватели микрочипов — обнаруживают локализованные флуоры в образцах в двух измерениях
- Спектрофлуориметры и считыватели микропланшетов — регистрируют среднюю флуоресценцию в образцах
- Проточные цитометры — анализ флуоресценции отдельных клеток в популяции образца
Посмотрите это видео, чтобы узнать больше о проточной цитометрии
Количественное определение
С появлением цифровой микроскопии количественное определение флуоресцентного сигнала стало обычным явлением во всех флуоресцентных приложениях и обеспечивает возможность измерения широкого диапазона параметров, включая:
- моб.
- Количество флуорофора, локализованного в клетках или даже в отдельных клеточных компартментах
- Скорость экспрессии генов и синтеза белка
- Скорость клеточной подвижности или движения внутриклеточных компонентов
- Количество ДНК, РНК или белка в образце
- Последовательность ДНК, РНК или белка
- Активность фермента
- Жизнеспособность
Для количественного определения флуоресценции требуется специальное программное обеспечение, и, в зависимости от экспериментального подхода, для калибровки приборов могут потребоваться флуоресцентные стандарты.
Флуоресцентная маркировка
Флуоресцентное мечение — это процесс ковалентного присоединения флуорофора к другой молекуле, такой как белок или нуклеиновая кислота. Обычно это достигается с помощью реактивного производного флуорофора, которое избирательно связывается с функциональной группой, присутствующей в молекуле-мишени.Наиболее часто меченые молекулы — это антитела, которые затем используются в качестве специфических зондов для обнаружения конкретной мишени. Флуоресцентная маркировка может применяться к широкому спектру систем обнаружения и позволяет проводить точные и количественные измерения.
Конъюгация флуорофора
Химически реактивное производное флуорофора требуется для мечения молекул. Обычные реакционноспособные группы включают амино-реактивные изотиоцианатные производные, включая FITC, реактивные с амином сукцинимидиловые эфиры, такие как NHS-флуоресцеин или NHS-родамин, и сульфгидрил-реактивные активированные малеимидом фторы, такие как флуоресцеин-5-малеимид.Реакция любого из этих реакционноспособных красителей с другой молекулой приводит к стабильной ковалентной связи, образованной между флуорофором и меченой молекулой. Изотиоцианаты давно используются в качестве первичного химического соединения для присоединения флуоресцентных красителей к белкам через первичные амины боковых цепей лизина. Химия NHS-сложных эфиров в настоящее время является предпочтительным методом мечения, поскольку он имеет большую специфичность по отношению к первичным аминам и обеспечивает более стабильную связь после процедуры мечения. Сульфгидрил-реактивные химические вещества занимают меньшую нишу в маркировке белков, где необходимо сохранить остатки лизина или где остаток цистеина специально предназначен для локализации флуоресцентного красителя на меченом белке.

Структуры NHS-флуоресцеина и FITC; два амино-реактивных производных флуоресцеина.
NHS-флуоресцеин активируется функциональной группой N -гидроксисукцинимидилового эфира (NHS-эфир). По сравнению с FITC производное NHS-сложного эфира обладает большей специфичностью в отношении первичных аминов в присутствии других нуклеофилов и приводит к более стабильной связи после мечения.
| NHS-флуоресцеин | FITC | |
| Альтернативные названия | 5/6-FAM SE | 5/6-FITC |
| Химическое название | Сукцинимидиловый эфир 5/6-карбоксифлуоресцеина | Смешанный изомер 5 (6) -флуоресцеинизотиоцианата |
| Молекулярный вес | 473.4 | 389,2 |
| Источник возбуждения | Спектральная линия 488 нм, аргон-ионный лазер | Спектральная линия 488 нм, аргон-ионный лазер |
| Длина волны возбуждения | 494 нм | 494 нм |
| Длина волны излучения | 518 нм | 518 нм |
| Коэффициент экстинкции | > 70,000 / M см | > 70,000 / M см |
| Номер CAS | 117548-22-8 | 27072-45-3 |
| Чистота | > 90% по данным ВЭЖХ | > 95% по данным ВЭЖХ |
| Растворимость | Растворим в ДМФ или ДМСО | Растворим в водных буферах до pH> 6 |
| Склад | Высушенные при -20%, защищать от влаги, использовать только свежие растворы | Высушенные при -20%, защищать от влаги, использовать только свежие растворы |
| Реактивные группы | Сложный эфир NHS, реагирует с первичными аминами при Ph 7.0 К 9,0 | Изотиоцианат, реагирует с первичными аминами при pH от 7,0 до 9,0 |
Сравнение NHS-флуоресцеина и FITC.
.
флуоресцентный — Викисловарь
Содержание
- 1 Английский
- 1.1 Произношение
- 1.2 Прилагательное
- 1.2.1 Производные условия
- 1.2.2 Связанные термины
- 1.2.3 См. Также
- 1.2.4 Переводы
- 1.3 Существительное
- 1.4 См. Также
- 2 каталонский
- 2.1 Прилагательное
- 2.1.1 Связанные термины
- 2.2 Дополнительная литература
- 2.1 Прилагательное
- 3 окситанский
- 3.1 Произношение
- 3,2 Прилагательное
- 3.2.1 Связанные термины
Английский [править]
Произношение [править]
- (Полученное произношение) IPA (ключ) : / ˌflʊəˈɹɛsənt /
- (США) IPA (ключ) : / flɔˈɹɛsɨnt /
- Гомофон: флуоресцентный, в некоторых произношениях
- Рифмы: -ɛsənt
Прилагательное [править]
флуоресцентный ( сравнительный более флуоресцентный , превосходный наиболее флуоресцентный )
- Флуоресценция или относящаяся к ней.
- Выставляется или производится флуоресценцией.
- флуоресцентные растения мерцали в темноте.
- Излучение видимого света в результате возбуждения люминофоров ультрафиолетовыми фотонами, возникающими при прохождении электрического тока через инертный газ, содержащий ртуть.
- Качество люминесцентных ламп за последние годы значительно улучшилось.
- Светится как от флуоресценции; яркий
- Ее рубашка была флуоресцентного оранжевого цвета.
Производные термины [править]
- лампа люминесцентная
- флуоресцентная метка
- зеленый флуоресцентный белок
Связанные термины [править]
- флуорофор
См. Также [править]
- радужный
- люминесцентный
Переводы [править]
или относящиеся к флуоресценции
|
|
Существительное [править]
флуоресцентный ( множественный флуоресцентный )
- Люминесцентная лампа.
- Флюоресцентные лампы гудели днем и ночью.
См. Также [править]
- лампа накаливания
Каталонский [править]
Прилагательное [править]
флуоресцентный ( мужской и женский род множественного числа флуоресцентный )
- флуоресцентный
Связанные термины [править]
- флуоресценция
Дополнительная литература [править]
- «флуоресцентный» в Diccionari de la llengua catalana, segona edició , Institut d’Estudis Catalans.
- «флуоресцентный» в Gran Diccionari de la Llengua Catalana, , Grup Enciclopèdia Catalana.
- «флуоресцентный» в Diccionari normatiu valencià , Acadèmia Valenciana de la Llengua.
- «флуоресцентный» в Diccionari català-valencià-balear , Antoni Maria Alcover и Francesc de Borja Moll, 1962.
Occitan [править]
Произношение [править]
-
Аудио (Béarn) (файл)
Прилагательное [править]
флуоресцентный m ( женский род единственного числа флуоресцентный , мужской род множественного числа флуоресцентный , женский род множественного числа флуоресцентный )
- флуоресцентный
Связанные термины [править]
- флуоресцентный
Люминесцентная лампа — Простая английская Википедия, бесплатная энциклопедия
 Традиционная люминесцентная лампа в форме трубки в простом приспособлении.
Традиционная люминесцентная лампа в форме трубки в простом приспособлении.
Люминесцентная лампа — это тип электрического света (лампы), в котором используется ультрафиолет, излучаемый парами ртути, для возбуждения люминофора, излучающего видимый свет. Есть два основных типа: традиционные флуоресцентные и компактные люминесцентные. Эта статья о традиционных люминесцентных лампах (с прямой трубкой).
Закупочная цена люминесцентной лампы часто намного выше, чем стоимость лампы накаливания той же мощности, и свет люминесцентных ламп выглядит иначе, чем свет ламп накаливания. [1] Люминесцентные лампы имеют более длительный срок службы и потребляют меньше энергии, чем лампы накаливания той же яркости. Люминесцентная лампа может сэкономить более 30 долларов США на расходах на электроэнергию в течение срока службы лампы по сравнению с лампой накаливания. [2]
Электрический ток пропускается к парам ртути внутри трубки, заставляя их излучать ультрафиолетовый (УФ) свет. Люминофор на стенках трубки поглощает ультрафиолетовый свет. Это заставляет электрон подпрыгивать на орбиталь с более высокой энергией.Когда электрон падает обратно на свою нормальную орбиталь, люминофор повторно излучает свою энергию в виде видимого света.
Балласт предотвращает прохождение слишком большого количества электричества через трубку. Он также запускает лампу с высоким напряжением на доли секунды, когда она включена. Балласт расположен внутри светильника в традиционных светильниках люминесцентных ламп. В компактных люминесцентных лампах балласт находится в основании или рядом с основанием лампы. Есть два типа балластов: магнитные и электронные.Магнитные балласты в основном вышли из употребления, так как они менее эффективны, чем электронные балласты, из-за них лампочка мерцает и они не запускаются мгновенно. Электронные балласты когда-то были дороже магнитных балластов, но сейчас цена примерно такая же.
Средний номинальный срок службы люминесцентной лампы в 8–15 раз больше, чем у ламп накаливания. [3] Люминесцентные лампы обычно имеют номинальный срок службы от 7000 до 15000 часов, тогда как лампы накаливания обычно производятся с расчетным сроком службы 750 часов или 1000 часов. [4] [5] [6]
Срок службы любой лампы зависит от многих факторов, включая рабочее напряжение, производственные дефекты, воздействие скачков напряжения, механические удары, частоту циклов включения и выключения, лампы ориентация и температура окружающей среды. Срок службы люминесцентной лампы значительно короче, если ее часто включать и выключать. В случае 5-минутного цикла включения / выключения срок службы люминесцентной лампы может быть сокращен до «близкого к сроку службы ламп накаливания». [7] Программа US Energy Star рекомендует оставлять люминесцентные лампы включенными, когда выходите из комнаты менее чем на 15 минут, чтобы этой проблемы не возникало. Если свет необходимо часто включать и выключать, можно использовать люминесцентные лампы с холодным катодом. Люминесцентные лампы с холодным катодом рассчитаны на гораздо большее количество циклов включения / выключения, чем стандартные лампы.
Ртуть внутри трубки токсична и превращает эти лампы в опасные отходы. После того, как луковицы перестанут работать, их необходимо сдать в центр утилизации.При нормальном использовании ртуть не может улетучиться, хотя она улетучится, если лампочка сломана. Если одна лампочка выходит из строя, обычно это не проблема. Рекомендуется открывать окна, чтобы проветрить комнату, и убирать разбитое стекло изолентой вместо пылесоса.
Многие люди и предприятия не хотят использовать люминесцентные лампы из-за содержания в них ртути. Возможными альтернативами являются галогенные, светодиодные и традиционные лампы накаливания.
Светодиодные лампыможно установить в люминесцентные лампы, но иногда электрику нужно сначала перемонтировать светильник, чтобы удалить балласт.
.Флуоресцентные микросферы | Bangs Laboratories, Inc.

Флуоресцентные микросферы являются опорой в диагностике и исследованиях в области наук о жизни, находя применение в качестве флуоресцентных маркеров, субстратов для анализа и эталонов инструментов. Чтобы соответствовать уникальным критериям эффективности, требуемым от микрочастиц в этих различных областях применения, мы храним обширный инвентарь флуоресцентных микросфер и предлагаем индивидуальные услуги по окрашиванию. См. Спектры доступных флуоресцентных красителей.
Наночастицы хелата европия

Наши высоко флуоресцентные наночастицы европия (III) обладают исключительной стабильностью в дополнение к хорошо функционализированным карбоксилированным поверхностям для ковалентного присоединения лиганда. Наши наночастицы Eu (III) использовались для разработки высокочувствительных анализов (микропланшет, боковой поток) на основе флуоресценции с временным разрешением (TRF) и в качестве меток в виде частиц в анализах хемилюминесценции. Гранулы поставляются в виде водных суспензий с содержанием твердого вещества ~ 1% (мас. / Об.).Просмотрите спектры возбуждения и излучения и ссылки на инструменты для считывателей тест-полосок TRF. Посмотрите, как мы выступаем против наших конкурентов, в нашей брошюре по хелату европия.
| Каталожный номер | Описание | Номинальный диаметр | Диапазон спецификаций | Лист технических данных |
|---|---|---|---|---|
| FCEU001 | Хелат европия PS — COOH | 0,10 мкм | 0,090 — 0,110 мкм | PDS 741.pdf |
| FCEU002 | Хелат европия PS — COOH | 0.20 мкм | 0,190 — 0,210 мкм | PDS 741.pdf |
| FCEU003 | Хелат европия PS — COOH | 0,30 мкм | 0,270 — 0,330 мкм | PDS 741.pdf |
| Каталожный номер | Описание | Лист технических данных |
|---|---|---|
| 21960 | Набор пробоотборника COOH хелата европия (1 мл, 0,10 мкм, 0,20 мкм, 0,30 мкм) | PDS 741.pdf |
ссылки
Лян Р-Л, Сюй Х-П, Лю Т-К, Чжоу Дж-В, Ван Х-Г, Рен З-Q, Хао Ф, Ву И-С.(2015) Быстрый и чувствительный метод иммуноанализа бокового потока для определения альфа-фетопротеина в сыворотке с использованием микрочастиц хелата европия (III) на основе тест-полосок бокового потока. Anal Chim Acta; 891: 277-283.
Soukka T, Paukkunen J, Härmä H, Lönnberg S, Lindroos H, Lövgren. (2001) Сверхчувствительный иммунофлуориметрический анализ с временным разрешением свободного простатоспецифического антигена с использованием технологии метки наночастиц. Clin Chem; 47 (4) 🙁 1269-1278
Ся Х, Сюй И, Кэ Р, Чжан Х, Цзоу М, Ян В.(2013) Высокочувствительный иммуноферментный анализ бокового потока на основе наночастиц для обнаружения остатка хлорамфеникола. Anal Bioanal Chem; 405 (23): 7541-4.
Yeo SJ, Bao DT, Seo GE, Bui CT, Kim DTH, Anh NTV,… Park H. (2017). Улучшение быстрого диагностического применения моноклональных антител против вируса птичьего гриппа подтипа H7 с использованием наночастиц европия. Научные отчеты, 7, 7933.
Туан Бао Д., Ким ДТХ, Парк Х, Кук БТ, Нгок, Нью-Мексико, Линь НТП,… Йео SJ. (2017) Быстрое обнаружение вируса птичьего гриппа с помощью флуоресцентного диагностического анализа с использованием пептидной тераностики на основе эпитопа, том 7, выпуск 7 1835-1846
Тан И, Чжан Х, Лю Х, Трофимчук Э, Фэн С., Ма Т,…, Лу Х.(2017) Преимущество микросфер полистирола, легированных Eu3 +, по сравнению с коллоидным золотом, используемым в иммунохроматографических анализах для обнаружения меламина в молоке. J Food Sci. Mar; 82 (3): 694-697 (микросферы хелата Eu 200 нм)
До Тхи Хоанг Ким Д.Т., Бао HP и Нгуен Минь Нгок, SJY. (2018). Разработка нового иммуноанализа на основе пептидных аптамеров для обнаружения вируса Зика в сыворотке и моче. Theranostics, 8 (13), 3629. (FCEU001, наночастицы COOH хелата европия 0,1 мкм)
Yu, ST, Bui, CT, Nguyen, AV, Trinh, TTT, & Yeo, SJ.(2018) Клиническая оценка экспресс-флуоресцентного диагностического иммунохроматографического теста на вирус гриппа A (h2N1). Научные отчеты, 8 (1), 13468. (наночастицы хелата Eu 200 нм, покрытые нуклеопротеином против гриппа A)
Флуоресцентный полистирол
Наши нефункционализированные микросферы подходят для нанесения покрытия путем адсорбции. См. Спектры доступных флуоресцентных красителей. См. Техническую заметку 204, Адсорбция на микросферы, для получения общего протокола адсорбции. Если не указано иное, флуоресцентные полимерные микросферы доступны в виде водных суспензий с концентрацией твердого вещества ~ 1% (масс. / Об.) В следующих стандартных объемах: 1 мл, 5 мл, 10 мл и 100 мл.
* Обратите внимание: если вы НЕ делаете заказ через веб-сайт, укажите номер партии, если доступно несколько партий.
.